|
Nombre Atomique |
6 |
Conductibilité thermique |
5,7 W m-1 K-1 |
|
Groupe |
14 |
Rayon atomique |
77,2 pm |
|
Période |
2 |
Configuration électronique |
[He] 2s2 2p2 |
|
Année de découverte |
Antiquité |
Électronégativité |
2,55 |
|
Masse Atomique |
12,0107 |
Résistivité électrique (20 °C) |
1375 μΩcm |
|
Nombre d’oxydation |
-4 +2 +4 |
État physique (20 °C) |
Solide incolore |
|
Densité (g dm-3) |
3513 (diamant, 93 K)
|
Volume molaire (cm3 mol-1) |
3,42 (diamant,
293 K) |
|
À l’état Naturel |
|
Molécule courante |
CO2 |
Propriétés thermiques |
|||
|
Point de fusion |
3550 °C |
Enthalpie de fusion |
105 kJ mol-1 |
|
Point d'ébullition |
4827 °C |
Enthalpie d'évaporation |
710,9 kJ mol-1 |
|
Température critique |
6470 °C |
Chaleur d'atomisation |
711,2 kJ mol-1 |
Énergie d' ionisation et abondance |
|||
|
Énergie de 1er ionisation |
1086,46 kJ mol-1 |
Abondance (air) |
336,7 ppm |
|
Énergie de 2ème ionisation |
2352,65 kJ mol-1 |
Abondance (croûte terrestre) |
200 ppm |
|
Énergie de 3ème ionisation |
4620,50 kJ mol-1 |
Abondance (océans) |
28 ppm |
|
Potentiel(s) d'ionisation |
11,26; 24,38; 47,89 eV |
|
|
|
Propriétés nucléaires |
|||
|
Isotope |
Masse atomique |
Abondance (%) |
Masse volumique à 20 °C |
|
12C 13C 14C |
12 13,003354838 14,003241988 |
98,90 1,10 ; |
2,25 g/cm3 |
|
|
|
|
|
|
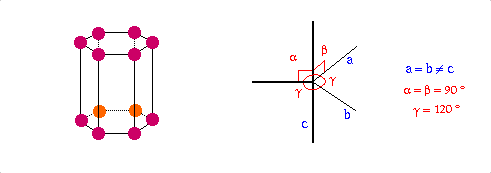
Structure cristalline |
Hexagonale |
|
a=246.12, c=670.78
P63/mmc |