|
Nombre Atomique |
9 |
Conductibilité thermique |
0,0256 W m-1 K-1 |
|
Groupe |
17 |
Rayon atomique |
70,9 pm |
|
Période |
2 |
Configuration électronique |
[He] 2s2 2p5 |
|
Année de découverte |
1886 |
Électronégativité |
3,98 |
|
Masse Atomique |
18,9984032 |
Résistivité électrique (20 °C) |
- |
|
Nombre d’oxydation |
-1 |
État physique (20 °C) |
Gaz jaune pâle |
|
Densité (g dm-3) |
1516 (liquid,
85 K) |
Volume molaire (cm3 mol-1) |
12,53 (liquid,
85 K) |
|
À l’état Naturel |
F2 |
Molécule courante |
NaF |
Propriétés thermiques |
|||
|
Point de fusion |
-219,62 °C |
Enthalpie de fusion |
1,02 kJ mol-1 |
|
Point d'ébullition |
-188,12 °C |
Enthalpie d'évaporation |
3,26 kJ mol-1 |
|
Température critique |
-128,86 °C |
Chaleur d'atomisation |
76,9 kJ mol-1 |
Énergie d' ionisation et abondance |
|||
|
Énergie de 1er ionisation |
1681,06 kJ mol-1 |
Abondance (air) |
- |
|
Énergie de 2ème ionisation |
3374,20 kJ mol-1 |
Abondance (croûte terrestre) |
625 ppm |
|
Énergie de 3ème ionisation |
6050,48 kJ mol-1 |
Abondance (océans) |
1,3 ppm |
|
Potentiel(s) d'ionisation |
17,42; 34,97; 62,71 eV |
|
|
|
Propriétés nucléaires |
|||
|
Isotope |
Masse atomique |
Abondance (%) |
Masse volumique à 20 °C |
|
19F |
18,99840321 |
100 |
1,58 g/dm3 à 101,3 kPa |
|
|
|
|
|
|
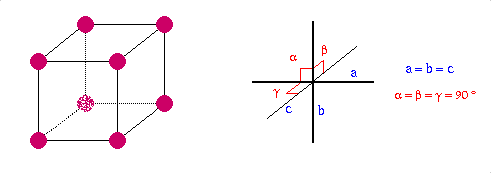
Structure cristalline |
Cubique
|
|
a=667
Pm3n |