La sou-pile

Saviez-vous que notre monde abonde en piles?
A peu près tous les métaux peuvent agir comme électrodes, et à peu près tout, sauf l'eau distillée peut être utilisé comme électrolyte. Cette caractéristique de notre monde est évidente partout où nous regardons. Les métaux rongés par la rouille et la corrosion peuvent être dits avoir servi d'électrode à la grosse pile de la nature.
Une pile est formée partout où deux métaux non semblables (non du même type) sont en contact avec un liquide qui peut agir chimiquement sur les deux métaux. Le liquide peut être acide ou alcalin en autant qu'il peut agir sur le métal pour en extraire les électrons ou atomes. Il y a un produit chimique optimum à utiliser avec n'importe quels métaux, mais bien d'autres produits chimiques agiront de façon satisfaisante comme électrolyte en autant qu'ils peuvent conduire l'électricité.
|
Électrodes pour l'électrolyse
Lors d'une électrolyse, on utilise deux électrodes soumises à une différence de potentiel.
Les deux électrodes sont le siège d'une réaction d'oxydo-réduction forcée (provoquée par le courant) :
L'une est le siège de la réaction de réduction, c'est la cathode (reliée au pôle –). L'autre est le siège de la réaction d'oxydation, c'est l'anode (reliée au pôle +).
Selon le sens de circulation conventionnel du courant, le courant continu, entre dans l'électrolyseur par l'anode et sort par la cathode
|
La tension produite entre les métaux non similaires dépend des propriétés chimiques de ces métaux. Quelqu'un à testé toutes les combinaisons possibles de métaux pour déterminer la tension relative entre n'importe quels de deux métaux. La liste (en ordre d'amplitude de tension et de relative polarité envers l'hydrogène comme référence OV) est appelée "série électromotrice des métaux".

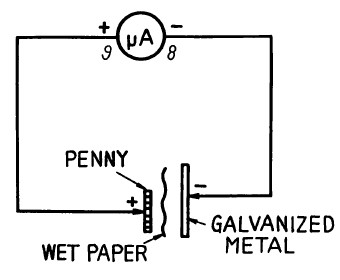
En choisissant des métaux qui sont les plus éloignés l'un de l'autre sur la liste on obtient les plus hautes tensions. La faculté de donner du courant est apparentée à d'autres propriétés chimiques, alors ne vous attendez pas à ce que les plus hautes tensions donnent aussi les plus hauts courants. Remarquez que le cuivre est bien séparé du fer, du zinc (utilisé pour galvaniser) et de l'aluminium, qui sont tous relativement actifs et donc capables de produire du courant pour votre sou-pile. Un sou en cuivre peut être utilisé comme électrode (+ anode) et bien d'autres métaux comme électrode (- cathode).
Pour des circuits qui fonctionneront avec cette pile à sou, voyez les projets oscillateur d’audio à sou-pile, Ration alimenté par une sou-pile et d'autres expériences qui ne requièrent qu'une très faible alimentation (par exemple: les circuits qui sont alimentés par la pile solaire).
Placez un morceau de papier ou de tissu humecté de vinaigre (comme électrolyte) entre un sou et un autre métal. Connectez le compteur en parallèle à cette "pile". Le montant de déflection au compteur est une indication de sortie de "pile".
Pour comparer les propriétés de livraison de courant de diverses piles à sou, utilisez une résistance de 100 ohms en shunt avec le compteur. Ceci augmente la courante pleine gamme du compteur de 0.25 mA à environ 2 m A. C'est une pile à sou surprenante qui doit être reconnue par ce circuit à compteur.
