|
Nombre Atomique |
21 |
Conductibilité thermique |
15,8 W m-1 K-1 |
|
Groupe |
3 |
Rayon atomique |
160,6 pm |
|
Période |
4 |
Configuration électronique |
[Ar] 3d1 4s2 |
|
Année de découverte |
1879 |
Électronégativité |
1,36 |
|
Masse Atomique |
44,955910 |
Résistivité électrique (20 °C) |
61 μΩcm |
|
Nombre d’oxydation |
+3 |
État physique (20 °C) |
Solide jaune argenté |
|
Densité (g dm-3) |
2989 (273 K) |
Volume molaire (cm3 mol-1) |
15,04 (273 K) |
|
À l’état Naturel |
|
Molécule courante |
ScSi2O7 |
Propriétés thermiques |
|||
|
Point de fusion |
1541 °C |
Enthalpie de fusion |
15,9 kJ mol-1 |
|
Point d'ébullition |
2836 °C |
Enthalpie d'évaporation |
376,1 kJ mol-1 |
|
Température critique |
5127 °C |
Chaleur d'atomisation |
376,02 kJ mol-1 |
Énergie d' ionisation et abondance |
|||
|
Énergie de 1er ionisation |
633,09 kJ mol-1 |
Abondance (air) |
- |
|
Énergie de 2ème ionisation |
1234,99 kJ mol-1 |
Abondance (croûte terrestre) |
30 ppm |
|
Énergie de 3ème ionisation |
2388,67 kJ mol-1 |
Abondance (océans) |
0,00004 ppm |
|
Potentiel(s) d'ionisation |
6,56; 12,80; 24,76 eV |
|
|
|
Propriétés nucléaires |
|||
|
Isotope |
Masse atomique |
Abondance (%) |
Masse volumique à 20 °C |
|
45Sc |
44,955910 |
100 |
3,0 g/cm3 |
|
|
|
|
|
|
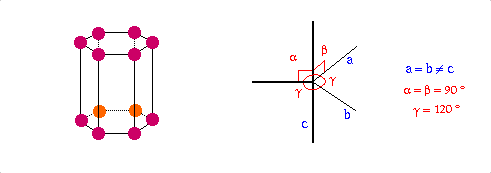
Structure cristalline |
Hexagonale |
|
a=330.90, c=527.3
P63/mmc |