Qu'est-ce que l'électricité?
Éclairage Et Installation Électriques 1961
Nos plus grands savants eux-mêmes ne peuvent en donner une définition exacte. Ils ont émis des hypothèses habiles, trouvé des comparaisons, formulé des théories. Ces théories nous semblent aujourd'hui assez justes.
Mais à défaut de savoir ce qu'est exactement l'électricité, nous devons nous contenter d'en étudier le comportement et les effets.
Ce sont des détails qu'il faut absolument connaître avant de commencer à manipuler tout ce qui se rapporte à ce fluide. En effet, l'électricité mal contrôlée devient un élément très dangereux qui peut tuer ou causer de grands ravages.
Avez-vous déjà songé que tout ce qui vous entoure occupe de l'espace et a un poids quelconque?
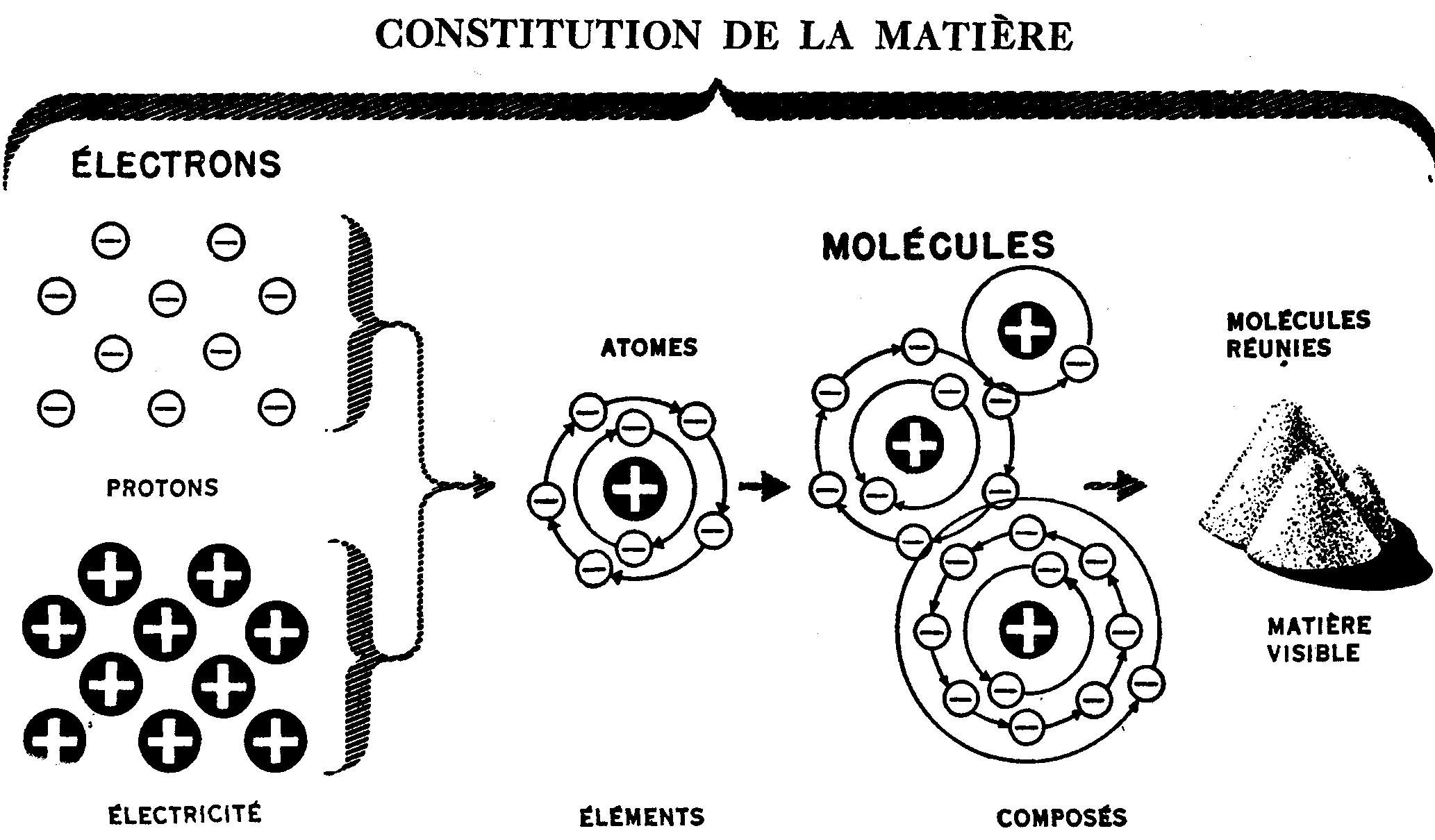
Les savants appellent matière les objets de notre entourage. Toute matière est formée d'infimes parties, appelées molécules. Ces molécules sont formées d'atomes, eux-mêmes composés d'électrons et de protons. Or, ces électrons et ces protons sont, en fait, de l'électricité.
Expliquons-nous par un exemple.
Si vous émiettez une brique ordinaire, il vous reste un petit tas de grains de sable et d'argile.
Ces grains sont de la matière, tout comme la brique était elle-même de la matière. Et cette matière n'a pas subi de changement dans sa substance. Le sable et l'argile peuvent être remoulés, recuits, et vous donner une nouvelle brique telle que la première.
Mais si vous pouviez pulvériser un petit grain de sable et le fractionner jusqu'à ses plus infimes particules (sans détruire le sable), vous en obtiendriez des milliards et des milliards de molécules. Celles-ci sont incroyablement ténues.
Il faudrait en effet 300 millions de molécules placées côte à côte pour atteindre un pouce de longueur. La molécule est la plus petite partie d'une substance quelconque qui puisse exister sans que cette substance perde son identité.
Si ténue que soit la molécule, elle n'est pas encore la plus petite particule de matière. Chaque molécule peut être fractionnée en deux ou plusieurs particules encore plus petites, appelées atomes. Mais vous n'avez plus alors la même substance.
La désintégration de la molécule du sable donne deux éléments différents: un gaz (l'oxygène) et un solide (la silice) ; ces éléments sont, en quelque sorte, les matériaux de construction de la matière. La plus petite particule de chacun des divers éléments (il y en a 92) est un atome.
En fractionnant notre molécule de sable, nous avons donc obtenu des atomes d'oxygène et des atomes de silice.
Inversement, nous pouvons utiliser deux ou plusieurs atomes pour construire une molécule. Les molécules d'acier, de cuivre, d'eau, de caoutchouc, de peinture, de pétrole, en fait, de toutes les substances, ne sont que des combinaisons de deux atomes ou plus.
Vous vous demandez peut-être quel chemin il vous reste à parcourir avant d'en arriver à l'électricité.
Rassurez-vous : vous arrivez au but.
Il ne reste plus qu'une transformation, mais il faut un broyeur d'atomes pour l'effectuer. Cet appareil, au moyen d'une énorme quantité d'électricité, peut littéralement pulvériser un atome en particules encore plus petites, soit en électrons et protons.
Ces particules infinitésimales de matière sont les plus petites que les savants aient encore réussi à isoler.
Vous savez déjà que les molécules sont minuscules. Mais n'oubliez pas que chaque molécule est formée de deux atomes ou plus, et que la plupart des atomes comportent plusieurs protons et électrons.
Pour former un seul grain de sable, il faudrait des millions de fois plus de protons et d'électrons qu'il y a d'hommes sur la terre. Les protons pèsent environ 2,000 fois plus et sont beaucoup plus gros que les électrons. Chaque proton et chaque électron renferment une charge d'électricité.
Afin de distinguer ces deux sortes de charges, l'on dit que l'électron a une charge négative ( — ), et le proton, une charge positive (+).
CONSTITUTION DE LA MOLÉCULE
II vous serait plus facile d'apprendre comment se bâtit une maison si vous assistiez à toutes les phases de sa construction. Vous verriez d'abord le coulage du solage en béton entre des formes en bois. Puis, la mise en place de la charpente, l'érection des murs et le clouage des lambris, finalement la construction de la toiture.
Bref, vous auriez vu dans leurs moindres détails les opérations de la construction. De même, il serait certainement plus facile de comprendre la constitution d'un atome si nous pouvions être témoins des phases de sa formation graduelle.
Malheureusement, il n'existe pas encore de microscope assez puissant pour nous permettre de distinguer les électrons, les protons, les atomes et même les molécules qui constituent la matière.
Toutefois, admettons, pour les besoins de la cause, que vous parveniez à grossir les électrons aux dimensions d'une petite bille blanche, et les protons à celles d'une grosse bille noire.
Eh ! bien, pour arriver à faire assez d'eau pour en remplir un verre il vous faudra des milliards de petites billes blanches (électrons) et exactement le même nombre de grosses billes noires (protons). Faudra-t-il y ajouter d'autres ingrédients?
Non, car toute matière, que ce soit l'eau, l'acier, la brique, le sucre, l'air et même notre corps, est constituée exclusivement d'électrons et de protons. Chaque molécule de l'eau dont vous voulez remplir le verre de tout à l'heure renferme deux atomes d'hydrogène et un atome d'oxygène.
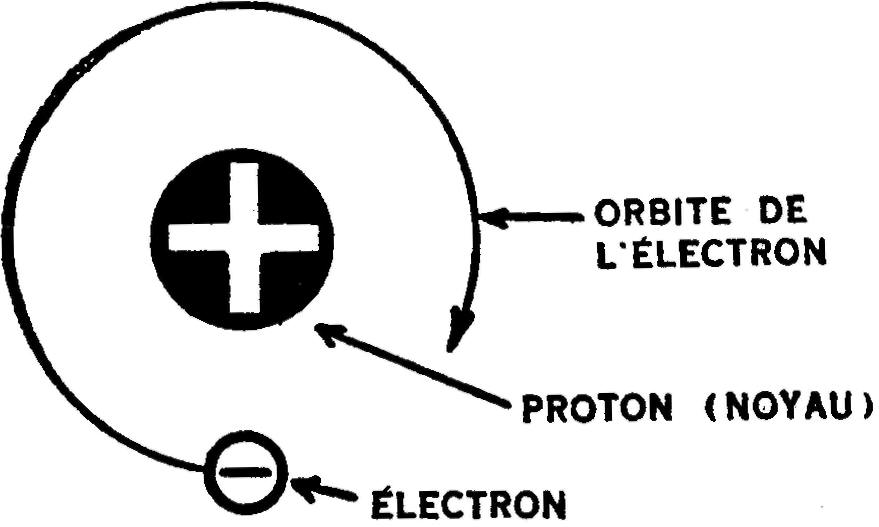
En admettant que vous ayez le désir et le pouvoir de construire des atomes afin de fabriquer de l'eau, vous commenceriez d'abord par l'atome d'hydrogène.
Après avoir fermement ancré un proton (bille noire) pour en former le centre ou noyau fixe, vous faites tourner un électron (bille blanche) autour de ce noyau. Vous obtenez ainsi un atome d'hydrogène. (Fig. 5). Puis vous en fabriquez un autre semblable, car chaque molécule d'eau renferme deux atomes d'hydrogène.
Fig. 5.— Gomment est constitué l'atome d'hydrogène.

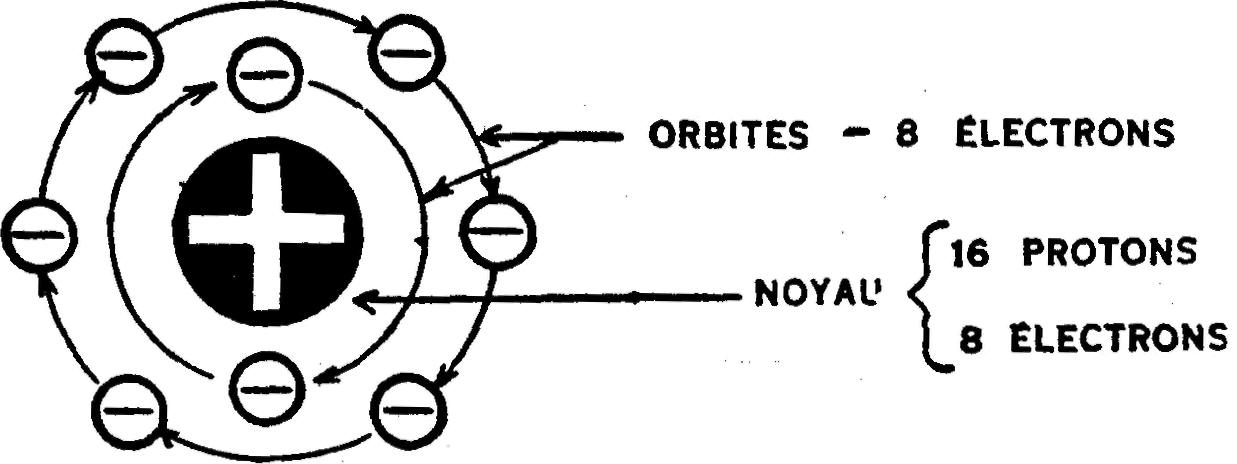
II vous faut en second lieu préparer un atome d'oxygène. Cette fois, le travail sera un peu plus difficile, car la constitution de l'atome d'oxygène est plus compliquée que celle de l'atome d'hydrogène, qui est le plus simple des 92 éléments.
Toutefois, l'atome d'oxygène — comme tous les atomes — ne renferme que des électrons et des protons. Dans l'atome d'oxygène, 16 protons et 8 électrons s'assemblent pour former le noyau, et 8 autres électrons tourbillonnent autour dans les orbites, tel qu'illustré en fig. 6.
Vous avez maintenant tous les atomes nécessaires pour préparer une molécule d'eau.
Fig. 6.— Un atome d'oxygène.
Vous auriez beau agiter ensemble les atomes d'hydrogène et d'oxygène jusqu'à en perdre l'haleine, que vous ne parviendriez jamais à les combiner en eau.
Mais faites jaillir une étincelle, et si l'explosion résultante ne vous décapite pas, vous allez découvrir qu'elle a produit de l'eau. Cette explosion est causée précisément par la combinaison des atomes d'oxygène et d'hydrogène, qui les transforme en eau. Il vous faudrait évidemment confectionner des milliards et des milliards de ces molécules d'eau pour remplir un verre.
La fig. 7 illustre la constitution d'une molécule d'eau.
Fig. 7.— Deux atomes d'hydrogène et un atonie d'oxygène forment une molécule d'eau.
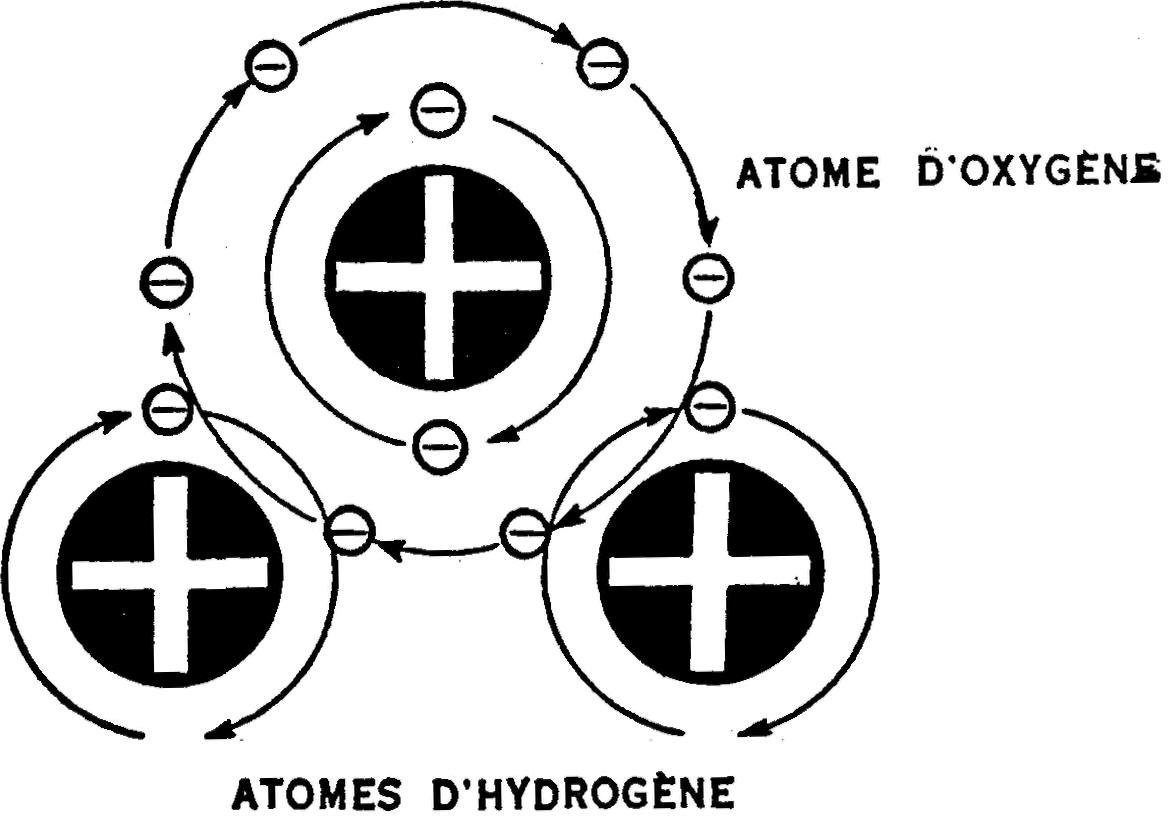
À noter que les électrons
de l'atome d'oxygène et des deux atomes d'hydrogène, dans leur tourbillonnement
rapide, enlacent leurs orbites respectifs, ce qui les soude l'un à l'autre et
assure ainsi la cohésion de la molécule. Les noyaux fixes des atomes se
maintiennent en place grâce à l'attraction de leurs électrons.
Vous avez maintenant une bonne idée de la constitution de l'eau. Mais il existe beaucoup d'autres substances, comme l'acier, la laine, l'air, le drap et les aliments, qui sont constituées d'une façon analogue.
La disposition et le nombre des protons et des électrons varient pour former les différents atomes des 92 éléments. Les atomes se combinent pour constituer les molécules.
Les molécules s'agglomèrent toutes en nombre incalculable jusqu'à former des particules de matières assez grosses pour être visibles à l'œil nu.
N'oubliez jamais qu'en fracturant tout corps en parties les plus petites possible, vous obtenez toujours, en définitive, des particules positives d'électricité — des protons — et des particules négatives — des électrons.
La fig. 8 vous aidera à retenir l'agencement de ces parties constituantes de la matière.
Fig. 8.— La totalité de la matière est formée de protons et d'électrons qui, en se combinant, forment des molécules ; celles-ci, à leur tour, forment, en se groupant, l'un ou l'autre des 92 corps connus.