
Électricité et matière
Jusqu'au début du siècle, les savants ont considéré l'électricité comme un fluide, puis comme une onde, et ils admettaient difficilement la possibilité d'un déplacement d'électrons libres dans la matière.
C'est pourtant le rappel de notions élémentaires actuelles sur la constitution de la matière qui permettra de comprendre la nature véritable de l'électricité.
1. Molécule
Les théories modernes ont prouvé que la matière qui forme apparemment une masse continue à nos yeux se compose, en réalité, de particules infiniment petites.
Par exemple, une pierre, à l'aspect pourtant si compact, se compose d'une multitude de molécules qui ne se touchent même pas.
Si l'on pouvait réduire cette pierre à l'extrême, la plus petite partie que l'on obtiendrait serait donc une molécule, mais actuellement on ne peut que la pulvériser et en retirer un petit grain de poussière composé d'un nombre déjà considérable de molécules beaucoup trop infimes pour être visibles même avec le plus puissant microscope.
Ces molécules sont maintenues les unes aux autres avec une fermeté extrême par une force, encore mal connue, que l'on désigne sous le nom de cohésion.
Une comparaison aide à imaginer l'infinité d'une molécule : dans une goutte d'eau, grossie au volume de la terre, chaque molécule qui la compose atteindrait à peine la dimension d'une orange !
Malgré que la molécule reste invisible à nos yeux, il a été cependant possible, par des méthodes compliquées, d'en calculer les dimensions, le poids et la charge électrique.
On définit la molécule comme la plus petite partie d'une substance pouvant exister à l'état libre et conserver les propriétés de cette substance.
2. Atome
La molécule peut elle-même être décomposée par des procédés chimiques. Les éléments obtenus prennent le nom d'atomes.
L'atome est l'un des éléments indivisibles d'une molécule et, dans la plupart des cas, ses propriétés physiques et chimiques diffèrent totalement de celles de la molécule.
Ainsi, le composé que forme la molécule du sel de table (chlorure de sodium) comprend un atome de chlore, gaz jaune et mortel, et un atome de sodium, métal mou qui décompose l'eau avec un dégagement de chaleur.
L'atome est la plus petite partie d'un élément qui puisse entrer dans une combinaison chimique ou dans un composé.
3. Constitution de l'atome
Au cours de la seconde moitié du XIXe siècle, les savants commencèrent à se rendre compte que l'atome lui-même était constitué de particules plus petites et différant entre elles.
De nombreuses expériences et différentes découvertes amenèrent Lord Ruther-ford (Lord Ernest Rutherford - Physicien anglais (1871-1937) auteur de plusieurs ouvrages sur la radioactivité.) à énoncer la théorie moderne selon laquelle la structure de l'atome ressemble à celle du système solaire :
au centre, un noyau extrêmement dense dont la masse représente la quasi-totalité de celle de l'atome ; à des distances relativement considérables, un nombre variable d'électrons gravitant autour du noyau, à la manière des planètes autour du soleil (fig. 1.1).
Fig. 1.1 Construction des atonies

Chaque électron porte une charge définie d'électricité négative; toutefois, l'atome, considéré dans son ensemble, est électriquement neutre, car le noyau, porteur d'une charge positive, neutralise la charge négative totale des électrons.
On estime le diamètre du noyau à 0.000,000,000,001 centimètre (10-12 cm) et le diamètre de l'atome entier serait environ 10,000 fois plus grand 10-8 cm).
L'électron est une particule indivisible d'électricité négative gravitant autour du noyau d'un atome.
4. Noyau
Le noyau lui-même se compose de particules : les protons, porteurs d'une charge positive et de masse 1, exprimée en unité atomique, auxquels s'ajoutent, le plus souvent, des neutrons qui sont formés de la réunion d'un proton (+) et d'un électron (-) ; leur charge électrique est donc nulle.
L'atome d'un élément bien déterminé possède un nombre immuable de protons qui représente le nombre atomique de l'élément.
Ainsi le noyau de l'atome d'hydrogène, élément le plus simple, contient 1 proton (nombre atomique : 1), celui de l'atome d'oxygène en contient 8 (nombre atomique : 8) et celui de l'atome d'uranium, 92 (nombre atomique : 92).
Le noyau, sphérique et composé de particules positives et de particules neutres (protons et neutrons), est le centre de l'atome.
Le nombre atomique permet donc de déterminer l'élément.
Le nombre de neutrons que renferme le noyau d'un atome est variable. Il existe des atomes d'hydrogènes qui ne renferment aucun neutron; d'autres en contiennent 1 ; certains en contiennent 2.
Le nombre total de protons et de neutrons que renferme le noyau détermine le poids atomique de l'atome.
Par exemple, le noyau de l'atome 4e fer est formé de 26 protons et de 30 neutrons; le poids atomique du fer est donc 56 (fig. 1.2).
Fig. 1.2 Atome de fer
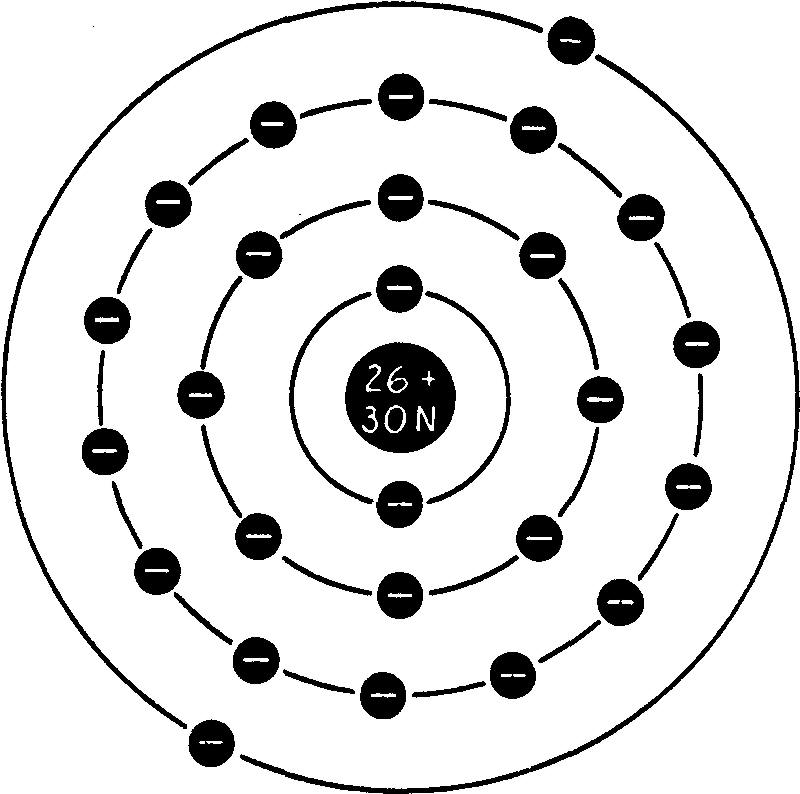
Un atome d'hydrogène qui renferme seulement 1 proton a pour poids atomique : 1 ; c'est la variété la plus commune d'hydrogène.
Un atome d'hydrogène qui contient 1 proton et 1 neutron a pour poids atomique 2; on l'appelle hydrogène lourd ou deutérium. Un atome d'hydrogène qui renferme 2 neutrons a pour masse atomique : 3.
Ces deux dernières variétés d'hydrogène constituent des isotopes de l'hydrogène, c'est-à-dire qu'au point de vue chimique elles restent toujours de l'hydrogène puisque leurs atomes ne contiennent qu'un proton (nombre atomique : 1).
5. Orbites ou couches électroniques
Le noyau d'un atome, à cause de ses protons, porte toujours une charge positive ; néanmoins, comme on l'a déjà dit, l'atome lui-même est rendu électriquement neutre par les électrons, en nombre égal aux protons, qui gravitent autour du noyau.
La masse atomique de l'électron qui est d'environ 1/1800 de celle du proton est négligeable par rapport à la masse totale de l'atome.
Ces électrons planétaires se déplacent sur des orbites qui s'étagent autour du noyau en couches concentriques.
Les électrons peuvent changer d'orbite ; à certains moments, ils passent d'une couche à l'autre, subissant ainsi un changement d'énergie dû au changement de position, mais il semble bien qu'ils ne puissent jamais circuler dans l'espace libre existant entre les orbites.
Les orbites ou couches électroniques constituent des niveaux différents d'énergie.
La figure 1.3 indique que le nombre maximum d'électrons pouvant circuler sur une orbite est bien déterminé.
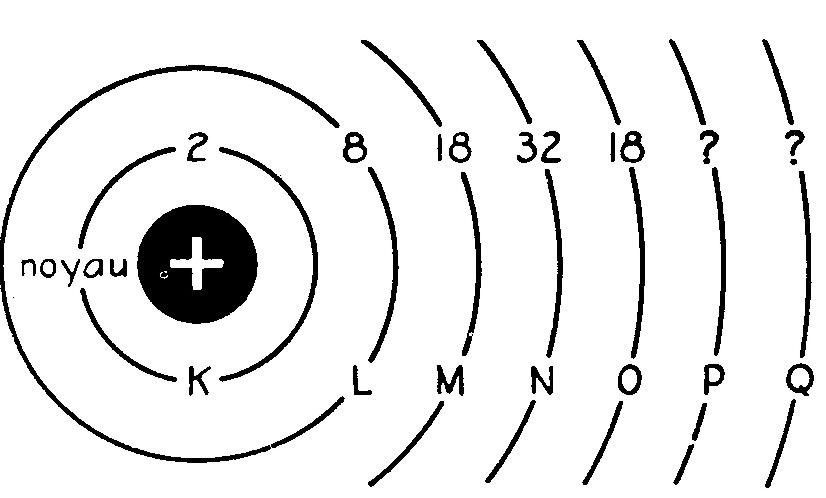
Chaque orbite est désignée par une lettre, K étant la couche la plus proche du noyau.
Comme les éléments actuellement connus n'utilisent que partiellement les orbites P et Q, nous ne savons pas quel nombre maximum d'électrons ces couches peuvent porter.
6. Ions
Comme on vient de le voir, l'atome est neutre à son état normal.
Il arrive cependant que, sous l'action de diverses forces, des électrons de la dernière orbite d'un atome, moins bien retenus par le noyau, se détachent pour aller se loger sur l'orbite d'un autre atome.
Le premier atome ayant perdu un électron (négatif) possède maintenant un excédent de charge positive, puisque le noyau demeure intact.
Le second atome acquiert, par contre, un excédent de charge négative puisqu'il a capté un électron (négatif).
Ce phénomène porte le nom de ionisation et l'on appelle ion un atome qui, ayant perdu ou gagné un ou plusieurs électrons, devient porteur d'une charge positive ou négative.
7. Les électrons et la marche du courant
On enseigne que le courant électrique se déplace, dans un circuit de la borne positive vers la borne négative à l'extérieur d'un générateur.
Ce sens conventionnel a été établi par certains savants avant que ne fût connue la théorie électronique; cependant il est arbitraire et le déplacement des électrons s'effectue toujours, au contraire, de la borne négative vers la borne positive.
On notera donc bien que le sens conventionnel du courant est l'inverse du déplacement réel des électrons. Le courant électrique est un courant d'électrons, c'est-à-dire un déplacement ordonné d'électrons libres.
Par exemple, le cuivre est bon conducteur de l'électricité parce que les atomes de ce métal libèrent facilement l'électron situé sur leur couche extérieure. Faiblement attirés par le noyau, les électrons libres circulent facilement d'un atome à l'autre.
C'est ce que l'on traduit en disant qu'un conducteur (un métal, généralement) est un corps qui permet un déplacement facile des électrons libres.
Dans le cas contraire, c'est un isolant. C'est ainsi que des matières comme le verre, la porcelaine, etc., sont composées d'atomes dont les électrons de la couche extérieure sont retenus plus fortement par le noyau.
On définira donc un isolant comme un corps qui s'oppose au déplacement des électrons.
On voit donc que le degré de conductibilité électrique des corps est en rapport étroit avec la facilité plus ou moins grande avec laquelle les électrons situés sur l'orbite extérieure des atomes peuvent se libérer.
En temps normal, les atomes libres se déplacent d'une manière désordonnée à une vitesse approchant celle de la lumière, mais la vitesse du courant (drift velocity) d'électrons dans une direction déterminée est pratiquement nulle jusqu'à ce qu'une différence de pression (différence de voltage) provoque le flot d'électrons.
Ainsi, s'explique l'apparition immédiate du courant électrique dès que l'on ferme l'interrupteur d'un circuit.
Le phénomène est analogue à celui qui se produit dans un système d'aqueduc. L'eau est présente dans les tuyaux, mais elle ne circule pas.
Dès qu'on ouvre un robinet, un afflux d'eau supplémentaire, dû à la pression de l'aqueduc, exerce une poussée et l'eau du tuyau se met en mouvement.
La vitesse du courant augmente en fonction de la demande; il en est ainsi pour le courant électrique. La figure 1.4 illustre le déplacement d'un électron libre.
Fig. 1.4 Déplacement d'un électron libre
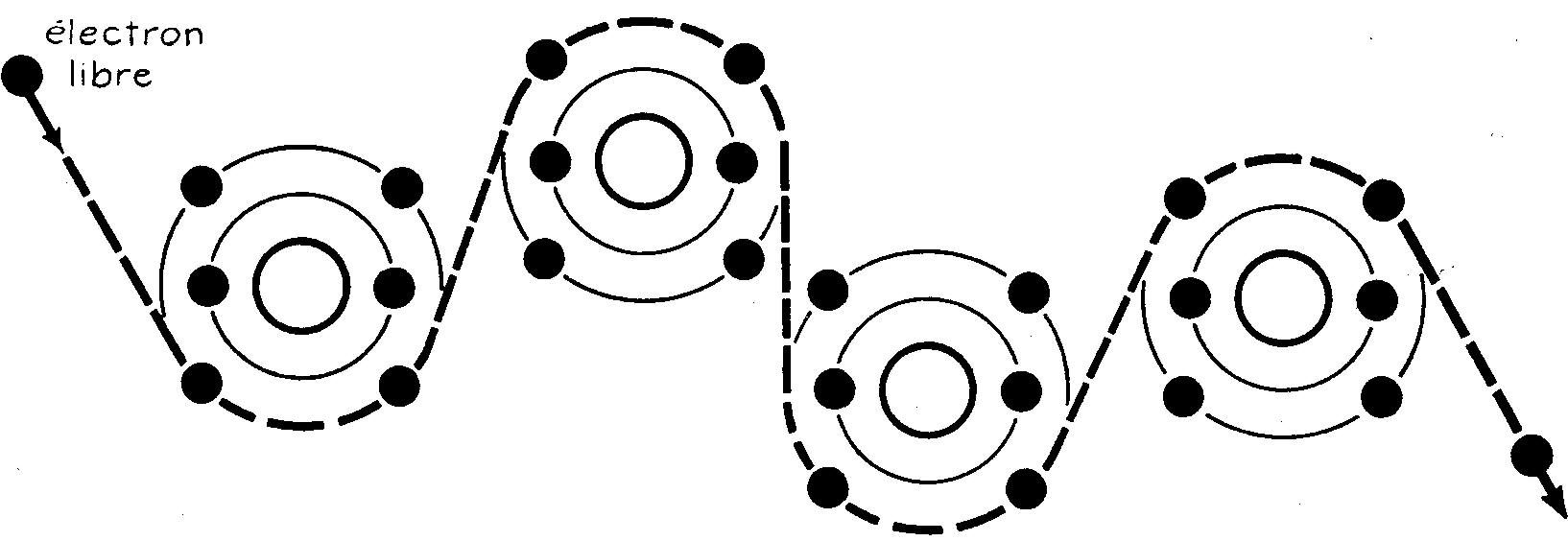
Dès qu'un atome perd un électron sa charge devient positive ; il attire alors un autre électron libre. Nous avons choisi l'atome de carbone pour sa structure relativement simple puisqu'il ne contient que six électrons.
QUESTIONNAIRE (Les réponses ne sont pas données)
1. Pourquoi le cuivre est-il bon conducteur d'électricité?
2. Expliquer la structure de l'atome.
3. Quel sens réel parcourt le courant électrique?
4. Définir la molécule, l'atome, le proton, le neutron, le noyau, l'orbite.
5. Comment les électrons s'ordonnent-ils autour du noyau?
6. Comment se comportent les molécules dans un corps?
7. Comment se différencient les structures des divers éléments?
8. Expliquer le phénomène d'ionisation.
9. Qu'est-ce qu'un électron libre?
10. En quoi consiste la différence entre un conducteur et un isolant? Comment l'explique-t-on?
