Piles primaires et secondaires
58. Définitions
Dans le langage courant, le mot pile désigne toujours une pile primaire, tandis que le nom d'accumulateur est réservé à la pile secondaire.
Le mot batterie s'emploie souvent à tort pour désigner une pile : il désigne un groupement de plusieurs générateurs électriques.
On dira donc batterie de piles, batterie d'accumulateurs, ou simplement batterie, pour indiquer un ensemble de piles ou d'accumulateurs reliés entre eux par des conducteurs.
Une pile transforme l'énergie potentielle chimique en énergie électrique et l'on en distingue deux sortes : la pile primaire et la pile secondaire.
Une pile primaire est constituée par deux électrodes plongeant dans un électrolyte, liquide ou pâteux. L'action chimique dissout l'une d'elles, généralement l'électrode négative, et lorsque celle-ci est dissoute la pile, déchargée, devient inutilisable puisqu'elle ne peut être rechargée.
Une pile secondaire, ou accumulateur, se distingue d'une pile primaire par la nature de ses électrodes et de son électrolyte ; elle peut être rechargée et, par une réaction chimique, retrouver ses propriétés premières. Il est possible aussi de remplacer ses électrodes lorsqu'elles sont trop attaquées.
Par définition, une pile secondaire est un appareil électrochimique capable d'emmagasiner de l'énergie électrique sous forme d'énergie potentielle chimique pour la restituer en courant électrique.
59. Facteurs de la force électromotrice d'une pile
Dans les piles, les électrodes baignent dans un électrolyte et permettent au courant de quitter la pile, puis de revenir à Pélectrolyte par un circuit extérieur.
Dans une pile simple, les électrodes sont constituées de cuivre et de zinc ; dans la pile sèche, elles sont remplacées par un récipient en zinc et une tige de carbone placée au centre. L'électrolyte, solution chimique, peut être un sel, un acide ou une solution alcaline.
Pour la construction d'une pile, le choix des métaux ne se limite pas au zinc ou au cuivre ; on peut utiliser des métaux tels que le fer, l'or, le carbone, le platine, etc.
Cependant, il est nécessaire que les deux électrodes soient de métaux différents et l'électrolyte est indispensable pour obtenir une réaction chimique sur chaque métal de manière à produire une différence de potentiel ; deux électrodes de même métal réagiraient pareillement et l'on n'obtiendrait pas de force électromotrice.
Le courant d'une pile est, nous l'avons dit, de l'énergie potentielle chimique transformée en énergie électrique.
L'effet de la réaction chimique est de faire naître une charge positive sur l'une des électrodes et une charge négative sur l'autre. Cette réaction s'appelle ionisation, c'est-à-dire transformation d'atomes en ions positifs et en ions négatifs.
Les facteurs de la force électromotrice d'une pile sont la nature de l'électrolyte et celle du métal employé pour les électrodes.
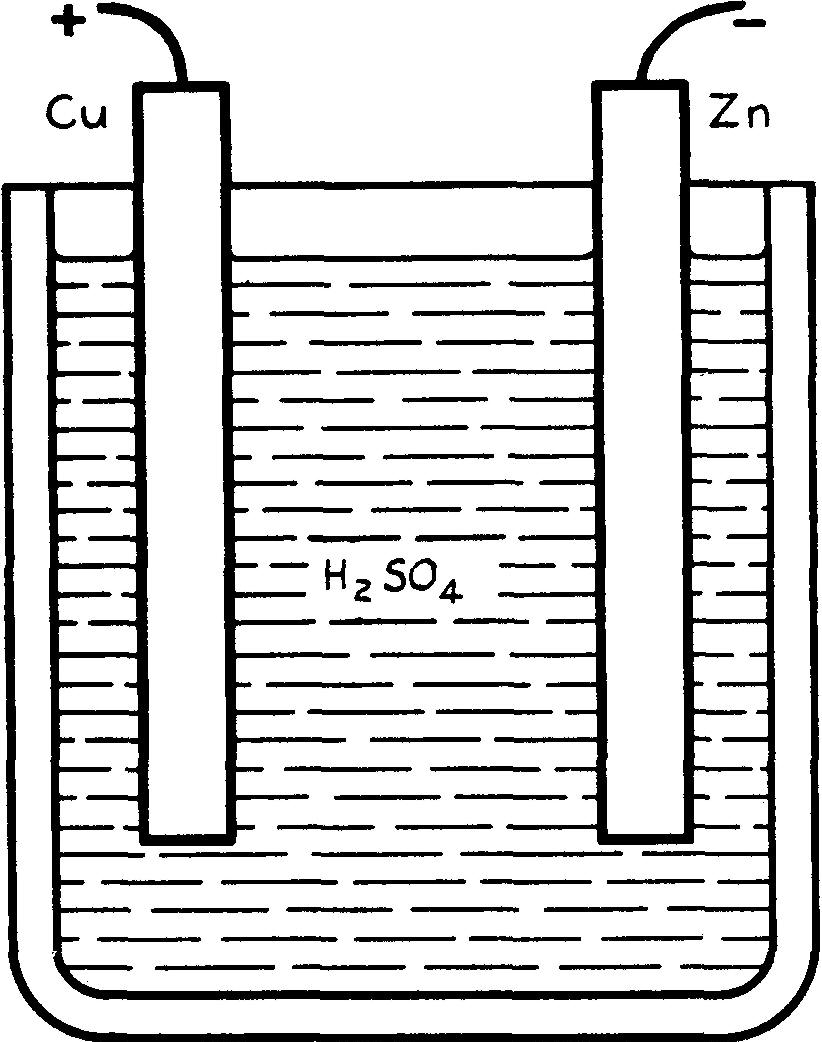
60. Pile de Volta
La pile de Volta, l'une des premières inventées, reste la plus simple.
Elle est constituée par un récipient en verre rempli d'un électrolyte, eau acidulée contenant environ 10% d'acide sulfurique, dans laquelle plongent les deux électrodes : une lame de zinc et une lame de cuivre, terminées par des bornes (fig. 6.1).
fig. 6.1 Pile de VOLTA

L'acide chlorydrique, les chlorures d'ammoniaque et de sodium sont aussi de bons électrolytes.
Fonctionnement
Si l'on relie les deux bornes par un circuit extérieur, celui-ci est parcouru par un courant électrique.
Le zinc est attaqué par l'électrolyte et le courant circule toujours, à l'extérieur de la pile du métal non attaqué (cuivre) au métal attaqué (zinc). Celui-ci possède un potentiel inférieur à celui-là et forme le pôle négatif.
Lorsqu'on plonge une électrode de zinc dans un électrolyte d'acide sulfurique on constate que ce métal se décompose en produisant de la chaleur et en libérant de l'hydrogène.
En d'autres termes, il transforme l'énergie potentielle chimique (ZnH2SO4) en énergie thermique.
Cette réaction s'écrit :
H2SO4 + Zn → SO4Zn + H2 + chaleur
Quand la réaction chimique s'effectue en circuit fermé, l'énergie potentielle chimique apparaît sous forme d'électricité; l'équation devient alors
H2SO4 + Zn → SO4Zn + H2 + énergie électrique
Dans la pile de Volta la différence de potentiel est de 1.08 volt environ.
Lorsqu'une pile primaire fournit un courant, les ions positifs d'hydrogène se combinent aux électrons de l'électrode en cuivre pour libérer de l'hydrogène.
Le dégagement des bulles d'hydrogène autour de la lame de cuivre forme une couche non conductrice qui augmente la résistance de la pile et diminue la surface de contact entre l'électrode et l'électrolyte ; ce phénomène s'appelle polarisation (fig. 6.2).
Fig. 6.2 Polarisation
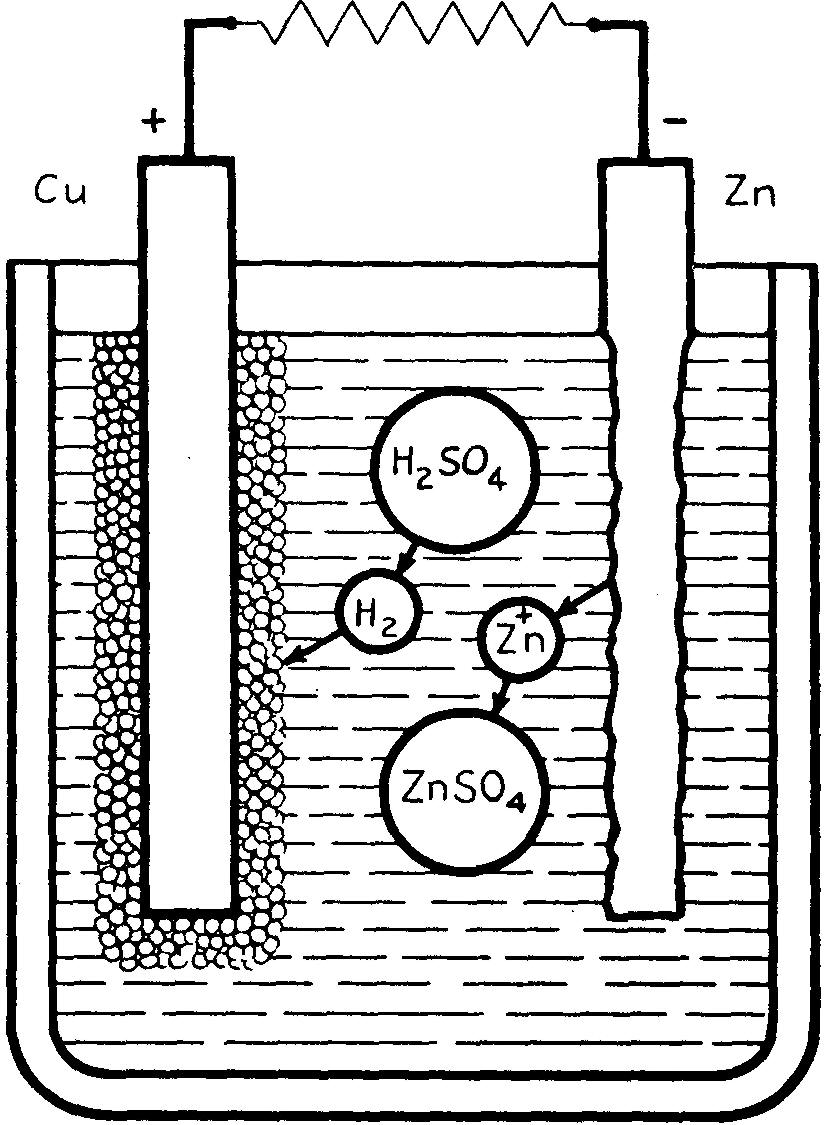
On peut expliquer de la façon suivante la réaction chimique du couple cuivre-zinc plongé dans un électrolyte d'acide sulfurique dilué.
Lorsqu'un courant circule, l'acide sulfurique attaque le zinc pour former du sulfate de zinc (SO4Zn) et un dégagement d'hydrogène (H2) ; cet hydrogène se dépose en grande partie sur l'électrode en cuivre la recouvrant ainsi graduellement d'une mince paroi de bulles qui diminue la surface de contact entre l'électrode de cuivre et l'électrolyte.
La formation du gaz hydrogène tend à produire un courant de sens opposé à celui du courant de la pile et augmente la résistance intérieure, réduisant ainsi le débit du courant et la force électromotrice.
Pour prévenir la polarisation, on emploie une substance riche en oxygène qui se combine avec l'hydrogène pour former de l'eau (H2O).
Un des meilleurs dépolarisants reste le bioxyde de manganèse (MnO2) qui libère suffisamment d'oxygène pour accaparer tout l'hydrogène et prévenir la polarisation.
La réaction chimique est la suivante:
2MnO2 + H2 → MnO3 + H2O
La combinaison du bioxyde de manganèse et de l'hydrogène forme de l'eau et un oxyde de manganèse plus faible.
Ainsi, la force contre-électromotrice de la polarisation ne se manifeste presque plus dans la pile, le courant garde une valeur normale et le voltage aux bornes demeure constant.
62. Pile Leclanché
Afin d'éviter le plus possible la réaction chimique secondaire, cause de la polarisation, plusieurs sortes de piles ont été conçues. La plus employée reste la pile Leclanché (fig. 6.3).
Fig. 6.3 Pile LECLANCHÉ
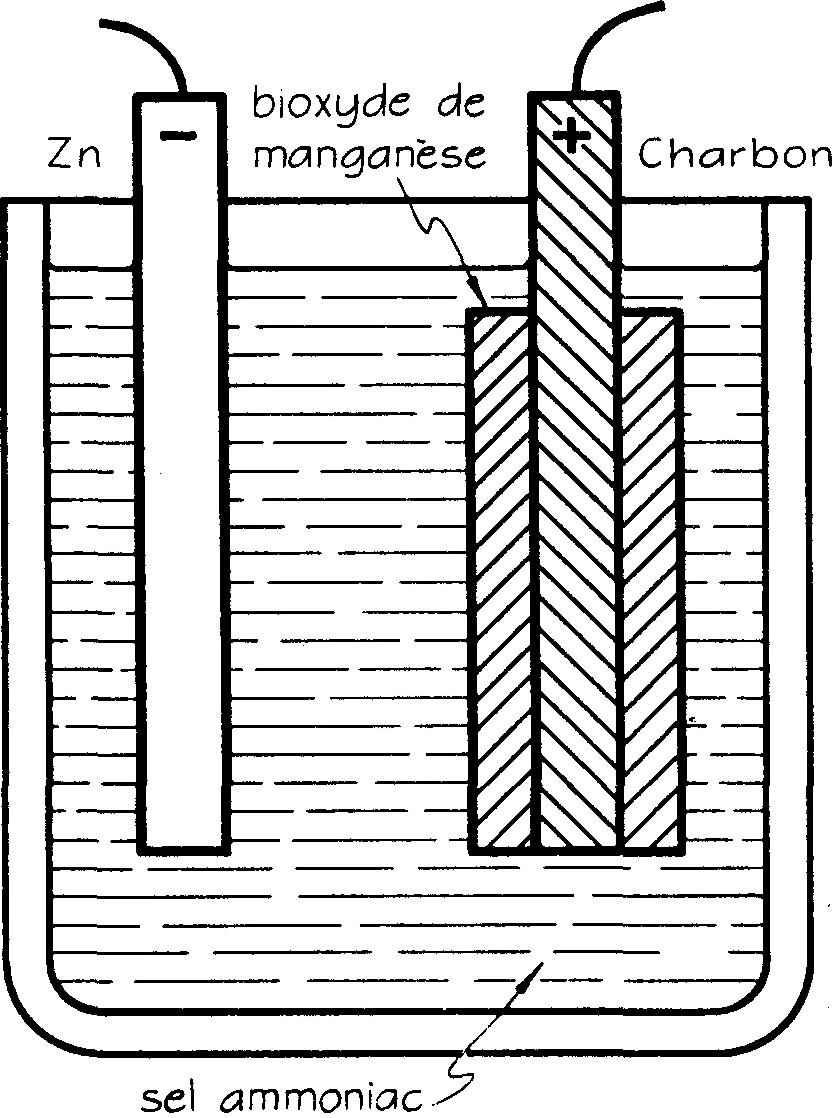
Cette pile a une électrode positive et est entourée d'une pâte de bioxyde de manganèse mélangée avec du charbon ; celui-ci constitue le dépolarisant, l'électrode négative est du zinc et l'électrolyte, une solution de chlorure d'ammoniaque (sel ammoniac).
En circuit ouvert, elle s'use très peu, mais son voltage aux bornes baisse rapidement quand la pile doit débiter des courants élevés qui la font se polariser vite.
Comparée aux autres piles, elle a un régime et une capacité appréciables à condition de n'exiger d'elle qu'un travail intermittent, avec des périodes de décharge relativement courtes et une intensité ne dépassant pas quelques centièmes d'ampères.
Dans ces conditions elle ne s'use pas rapidement et, pour cette raison, on l'utilise surtout dans les circuits de sonnerie où elle dure un an et plus ; cependant on la remplace généralement par la pile sèche.
63. Pile sèche
La pile sèche (fig. 6.4) est tout simplement une pile Leclanché dont on immobilise le liquide à l'aide de certaines substances, cellulose, amiante, gélatine, sciure de bois, papier, etc., capables d'absorber l'électrolyte.
Fig. 6.4 Pile sèche (Navpers - Basic electricity)

Sans l'humidité conservée par ces substances, il ne se produirait pas de réaction chimique et par conséquent, pas d'énergie électrique ; l'appellation pile sèche n'est donc pas strictement correcte.
Un récipient en zinc, tapissé intérieurement d'un isolant (papier buvard) pour le séparer du mélange, constitue le plus souvent l'électrode négative et un crayon en charbon, placé au centre, l'électrode positive.
Un mélange finement moulu de charbon, de bioxyde de manganèse, de chlorure de zinc, de sel ammoniac (chlorure d'ammoniaque) et d'eau entoure le crayon et le maintient solidement fixé.
Le sommet du récipient en zinc est fermé par plusieurs épaisseurs de carton ondulé formant couvercle et scellé avec du goudron, afin de prévenir l'évaporation ; entre le couvercle et le mélange, on laisse un petit espace d'air.
Chaque électrode se termine par une borne pour le branchement des conducteurs.
Enfin, la pile est recouverte extérieurement d'un carton fort portant généralement la marque du fabricant. La pile sèche s'apparente donc à la pile Leclanché et par sa conception et par son fonctionnement.
Le sel d'ammoniac NH4C1 sert d'électrolyte, le chlorure de zinc ZnCl2 réduit la réaction interne et le bioxyde de manganèse agit comme dépolarisant ; le charbon en poudre diminue la résistance intérieure en augmentant la surface de contact de l'électrode négative avec l'électrolyte et le papier buvard remplit deux fonctions:
a) il empêche le contact direct du mélange humide avec le zinc et
b) il permet à l'électrolyte de ne réagir que lentement sur le zinc. Les réactions chimiques sont les suivantes:
Zn + 2NH4Cl + 2MnO2 -» ZnCl2 + 2NH3 + H2O +Mn2O
L'électrolyte dissout le zinc. Il en résulte du chlorure de zinc, de l'ammoniaque et la libération de deux atomes d'hydrogène.
Ces deux atomes d'hydrogène se combinent avec l'oxygène du bioxyde de manganèse pour former de l'eau et du trioxyde de manganèse.
Seule, la transformation du zinc en chlorure de zinc produit un effet utile.
L'ammoniaque et le chlorure de zinc se dissolvent dans l'électrolyte et lorsque la transformation chimique est entièrement terminée (membre droit de l'équation) la pile est épuisée.
Grâce à ses avantages, la pile sèche est très employée ; elle donne une force électromotrice de 1.5 volt pour un encombrement minime et un maximum d'intensité pendant des périodes courtes et espacées.
La quantité d'électricité qu'elle peut fournir dépend du temps pendant lequel elle débite sans interruption et de l'intensité exigée ; sa capacité augmente avec ses dimensions.
Lorsque la tension tombe à 1.2 ou 0.75 volt elle devient trop faible et il faut la remplacer.
L'intensité d'une pile neuve est de 30 ampères environ et ne doit jamais descendre au-dessous de 10 ampères.
On ne doit jamais laisser trop longtemps le circuit d'une pile fermé ; l'emploi intermittent permet au dépolarisant de réagir et la pile retrouve à peu près son état normal, alors qu'en fermant le circuit trop longtemps la production d'hydrogène devient trop forte et celui-ci n'est plus absorbé au fur et à mesure par le dépolarisant :
la pile se gonfle et peut même éclater
Une pile inutilisée se détériore, malgré tout, lentement, car il se produit une réaction chimique du mélange humide.
Un entreposage dans un endroit frais et sec réduit cette réaction au minimum. La durée des piles varie proportionnellement à leur grosseur ; celle d'une pile de grosseur no 6 est d'un an environ.
64. Pile RM.
Depuis l'apparition d'appareils électroniques portatifs (Walkie - talkie), et d'appareils auditifs, la nécessité se faisait sentir d'une pile sèche, de petite dimension, de grande capacité, à l'épreuve de la température et de l'humidité ; il en est résulté la production de la pile RM., connue aussi sous les noms de pile Ruben ou pile au mercure (fig. 6.5).
Fig. 6.5 Piles Roben (Navpers - Basic electricity)

Elle se présente sous la forme d'un cylindre de 1/2 à 1 pouce de diamètre sur 1 pouce de hauteur, suivant sa capacité ; plus dispendieuse que la pile sèche, elle débite 4 à 7 fois plus de courant avant que ne survienne une baisse rapide de voltage.
L'électrode négative est un mélange d'oxyde de mercure et de charbon moulu contenu dans un récipient en fer-blanc ; l'électrode positive affecte la forme d'une boulette de zinc, faisant saillie au-dessus et au centre du récipient. Une solution d'hydroxyde de potassium constitue l'électrolyte.
La force électromotrice de la pile RM. est d'environ 1.34 volt en circuit ouvert et tombe à 1.31 volt et 1.24 volt en circuit fermé, mais elle conserve une intensité normale et bien qu'elle soit inférieure de 0.2 volt à celle de la pile sèche, elle se maintient plus régulièrement pendant toute la durée.
65. Caractéristiques d'une pile
Les caractéristiques d'une pile sont :
1 - la force électromotrice qui varie avec la nature des électrodes et de l'électrolyte, mais ne dépend ni de la quantité de l'électrolyte, ni de la grosseur ou de la surface des électrodes;
2 - le régime ou intensité de courant pouvant être débitée sans usure trop rapide;
3 - la résistance intérieure qui dépend de la dimension et de l'écartement des électrodes, de la résistance de l'électrolyte ; elle est inversement proportionnelle à la surface des électrodes et directement proportionnelle à la distance qui les sépare.
4 - la capacité ou quantité totale d'électricité qui peut être fournie au régime normal d'utilisation sans que la pile s'épuise ; elle dépend de la surface des électrodes et de la quantité d'électrolyte.
Les piles, comme les accumulateurs, sont d'un coût élevé ; on ne les emploie donc que dans les cas suivants :
a) fournir un courant de faible débit (sonneries électriques);
b) disposer d'une source de courant portative (lampes de poche, radios portatifs, etc.);
c) alimenter un circuit de secours en cas de panne du circuit normal (hôpitaux, établissements publics, etc.).
66. Pile WESTON
Nous mentionnerons la pile étalon Weston, car elle sert, dans certains travaux, à comparer des voltages.
La construction très soignée et les éléments qui la composent permettent de produire des piles d'une force électromotrice de 1.0186 volt à quelques cent-millièmes de volt près.
La pile Weston est essentiellement constituée par un verre en H (fig. 6.6), parfaitement scellé, qui renferme dans une de ses branches du mercure (cathode) et dans l'autre, un amalgame de cadmium (anode).
Ces "électrodes" sont recouvertes d'une solution de sulfate de cadmium (électrolyte).
Fig. 6.6 Pile étalon WESTON
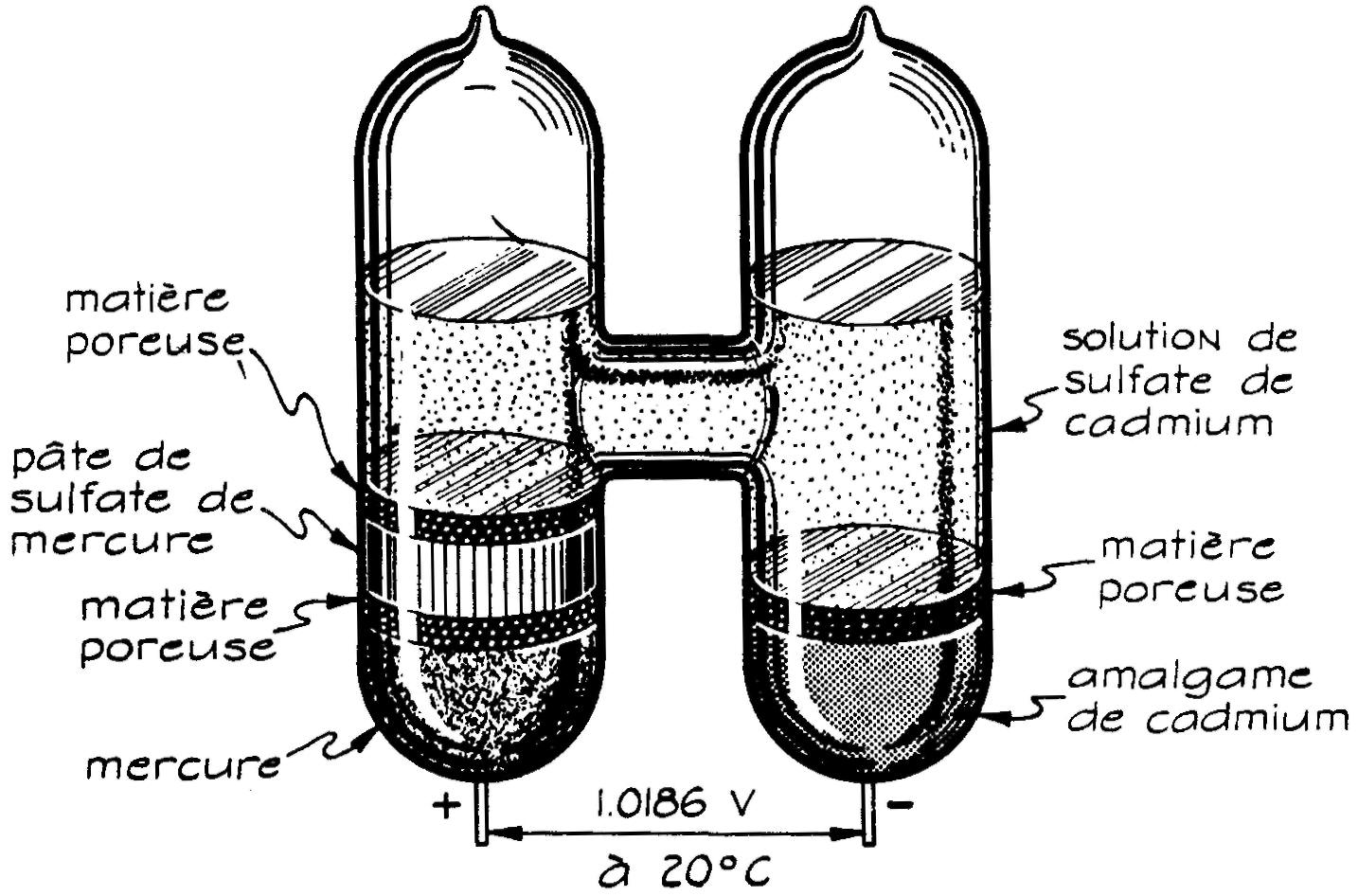
On utilise surtout la pile à électrolyte non saturé dont la concentration reste constante.
II existe un type à électrolyte saturé dans lequel des cristaux de sulfate de cadmium laissés à l'état libre maintiennent la saturation de l'électrolyte à toutes les températures.
La résistance de la pile Weston est de 200 ohms et son coefficient de température (cf. section Unités de mesure) est pratiquement nul. Les fils d'électrodes sont scellés à la partie inférieure des branches du tube.
67. Accumulateurs
Les propriétés chimiques de l'électrolyte associées aux propriétés physiques des électrodes permettent de recharger une pile secondaire, c'est-à-dire de lui redonner pratiquement toutes ses caractéristiques premières en l'alimentant par un courant continu dans le sens opposé à la marche du courant qu'elle débite.
Dans une pile secondaire de bonne qualité, les électrodes et les produits de la réaction chimique doivent rester insolubles dans l'électrolyte.
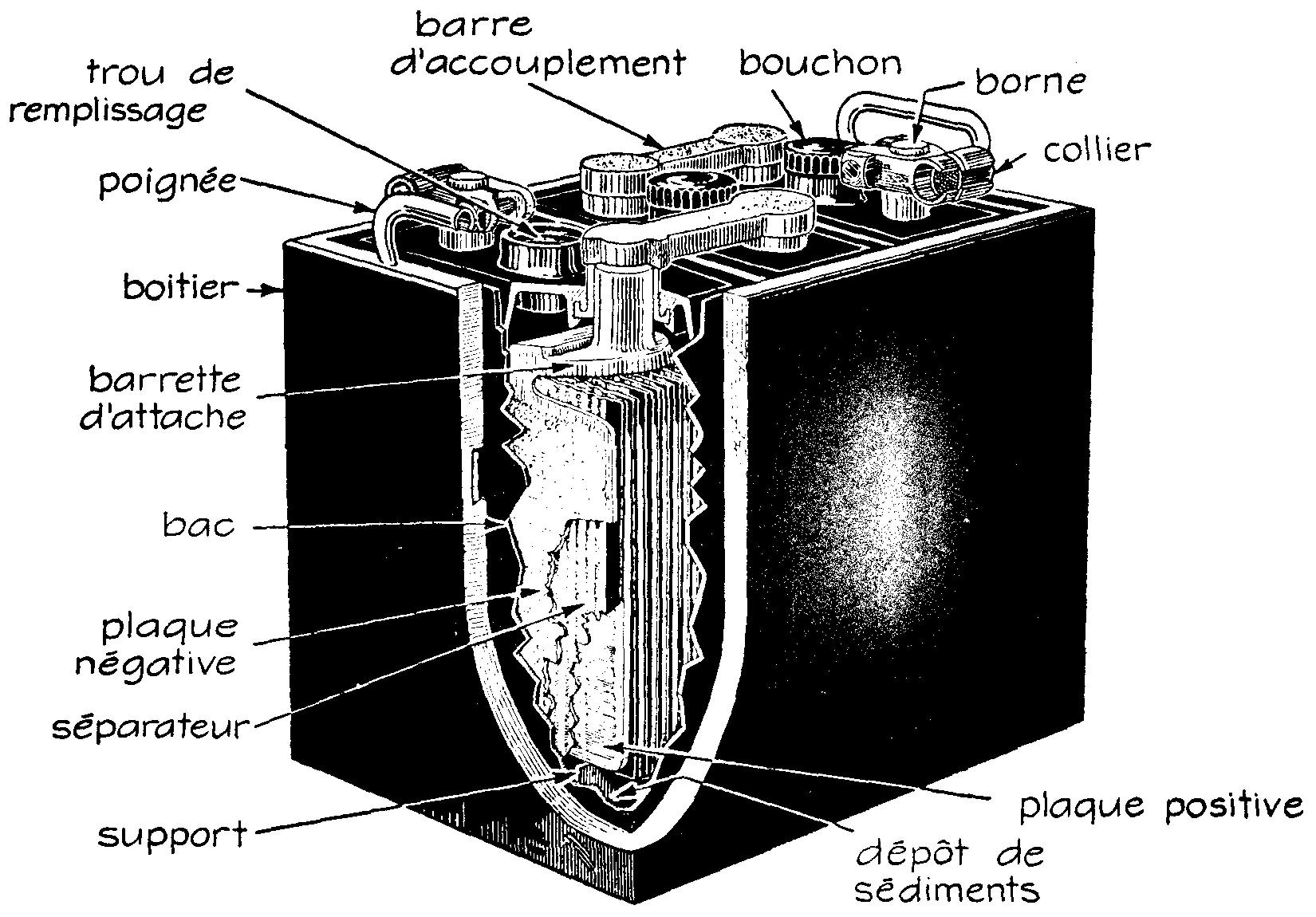
La puissance d'une seule pile étant habituellement insuffisante pour les services demandés, on les groupe en batteries de trois, six éléments ou plus, afin d'obtenir le voltage nécessaire ; le récipient compartimenté qui les contient (bac) est constitué de caoutchouc, d'un composé d'asphalte, ou autre matériau mauvais conducteur et résistant à la corrosion des acides.
Chaque compartiment contient une pile ; une ouverture permet de surveiller le niveau de l'électrolyte et de le compléter au besoin. Le bouchon qui ferme l'ouverture permet la ventilation par les petits trous dont il est percé.
L'accumulateur au plomb, de large utilisation dans l'industrie automobile, doit posséder une grande capacité sous un volume restreint.
À cet effet, on utilise comme électrodes des plaques minces offrant le maximum de surface active. Ces plaques sont reliées en parallèle et en deux groupes distincts, le groupe positif relié lui-même à la borne positive et le groupe négatif à la borne négative.
Chaque plaque positive est encadrée par deux plaques négatives, de manière que la réaction chimique s'effectue d'une manière égale des deux côtés ; le contraire provoquerait le cintrage des plaques.
C'est pour cette raison qu'un accumulateur de ce type comprend un nombre de plaques négatives supérieur d'une unité à celui des plaques positives ; le nombre total des plaques est donc toujours impair.
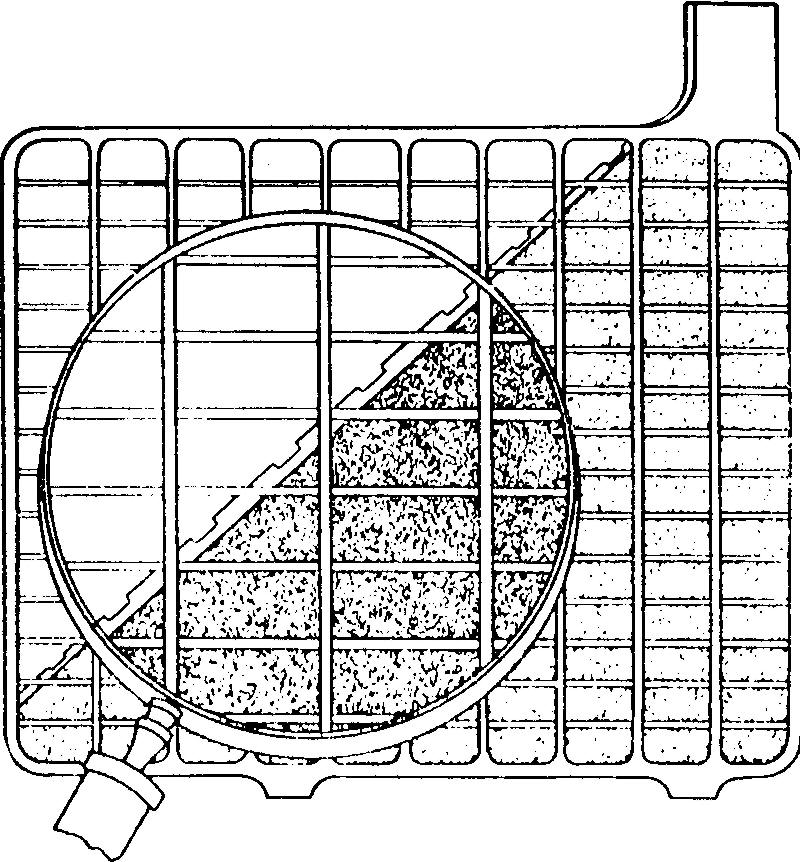
Entre les plaques on insère, pour éviter qu'elles ne se touchent, des séparateurs en substance isolante et poreuse (bois de cèdre, caoutchouc ou fibre de verre) qui sont rainures verticalement pour permettre aux sédiments de tomber au fond du bac et aux gaz de s'échapper de celui-ci (fig. 6.7).
Fig. 6.7 Plaques d'accumulateur au plomb (Navpers - Basic electricity)

La matière active utilisée étant peu solide, friable et mauvaise conductrice de l'électricité on l'incorpore dans une grille ou carcasse faite d'un alliage de plomb et d'antimoine, qui possède une excellente résistance mécanique et une conductibilité électrique facilitant le passage du courant de la matière active à la borne.
Il existe plusieurs procédés pour constituer les plaques.
Le plus courant consiste à garnir les trous de grille avec une pâte d'oxyde de plomb (PbO), poreuse, qui se laisse facilement traverser par l'électrolyte (fig. 6.8) composé d'eau distillée (80 à 90%) et d'acide sulfurique (10 à 20% ).
Fig. 6.8 Garniture des trous de grille d'une plaque (Navpers - Basic electricity)
Lorsque la pâte est sèche on
plonge les grilles dans l'électrolyte et l'on fait passer un courant continu
sous l'action duquel les plaques positives se transforment en peroxyde de plomb
(PbO2) et les plaques négatives en plomb
spongieux pur (Pb).
Au cours de cette période on accélère souvent les réactions chimiques en ajoutant à l'électrolyte certains produits.
L'accumulateur est alors prêt à fonctionner (fig. 6.9).
Fig. 6.9 Coupe d'un accumulateur (Navpers - Basic eleetricity)
Fonctionnement
Dans un accumulateur, le processus reste le même que dans une pile : réaction d'un électrolyte sur deux électrodes de nature différente, mais ici le phénomène chimique devient réversible.
On sait qu'avec des électrodes de même nature il ne se produirait aucun courant et nous avons vu comment on les différencie en faisant passer un courant continu de la borne positive à la borne négative, c'est-à-dire en sens inverse du courant que l'accumulateur débitera pendant la décharge.
Il serait faux de croire que l'accumulateur restitue simplement le courant qu'il a reçu.
Le courant qu'on lui a fourni s'est accumulé sous la forme d'une énergie potentielle chimique et c'est encore sous l'effet d'une réaction chimique que cette énergie potentielle sera restituée sous forme de courant électrique.
Nous allons analyser ces réactions chimiques (fig. 6.10).
Fig. 6.10 Réactions chimiques dans un accumulateur (Navpers - Basic electricity)
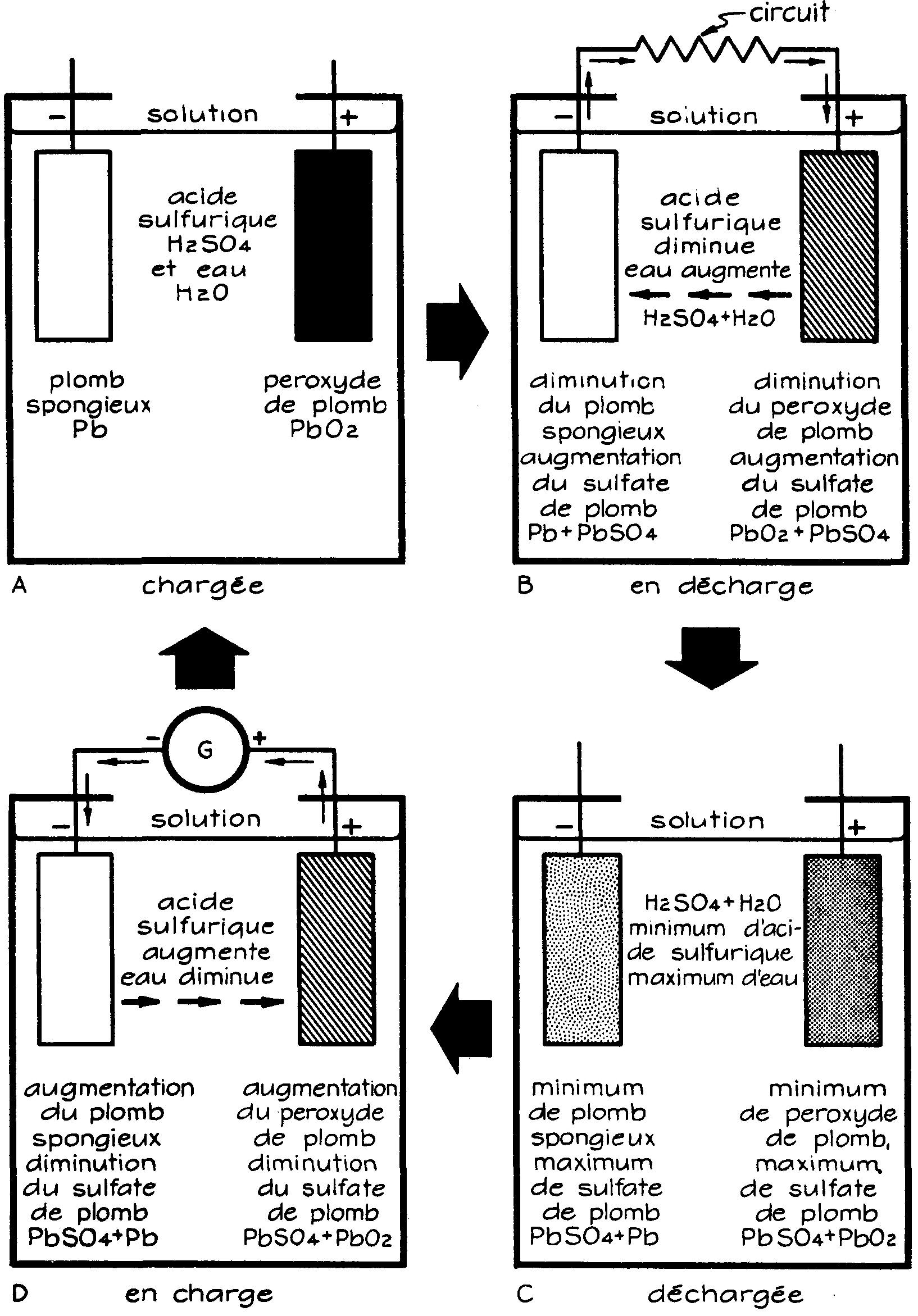
a) Décharge
Lorsque l'accumulateur fonctionne en décharge, la circulation du courant s'effectue (à l'intérieur de l'accumulateur) de la plaque négative à la plaque positive. Sens conventionnel.
L'électrolyte est décomposé en hydrogène (H2) et radical sulfate (SO4).
Sur la plaque positive, l'hydrogène réagit en se combinant avec l'oxygène (O2) du peroxyde de plomb (PbO2) pour former du plomb et de l'eau et, pour cette raison, la densité de l'électrolyte va s'affaiblir graduellement au fur et à mesure que se développe la réaction.
C'est graduellement aussi que s'effectuent la libération de l'oxygène et la transformation du peroxyde de plomb en plomb pur.
Sous l'action du radical sulfate (SO4) toutes les plaques vont maintenant se recouvrir de sulfate de plomb (PbSO4).
L'équation chimique qui traduit cette transformation est la suivante:
Pb + PbO2 + 2H2SO4 ⇔ 2PbSO4 + 2H2O
La double flèche indique que la réaction est réversible, comme nous le verrons pendant la charge.
Le terme gauche de l'équation caractérise l'état d'un accumulateur chargé à pleine capacité, tandis que le terme de droite indique que l'accumulateur est complètement déchargé ; à ce moment le liquide, transformé en eau, n'est plus électrolytique et les électrodes recouvertes complètement de sulfate de plomb sont devenues identiques.
Il est donc impossible qu'il se produise du courant.
Pratiquement, il faut arrêter la décharge avant que la réaction chimique ne soit achevée, sous peine de détériorer l'accumulateur.
En effet, d'une part (1) le sulfate de plomb oppose une grande résistance au passage du courant et, d'autre part (2) il occupe un grand volume.
Si l'on attendait trop, il remplirait complètement l'espace séparant les plaques et cintrerait celles-ci.
b) Recharge
Sous l'effet d'un courant continu circulant (à l'intérieur de l'accumulateur) de la borne positive à la borne négative, le radical sulfate (SO4) se libère graduellement du sulfate de plomb des plaques positives et négatives et se combine au fur et à mesure avec l'hydrogène de l'eau pour former de l'acide sulfurique (H2SO4) ; le liquide va donc redevenir électrolytique et sa densité augmentera pendant toute la durée de la charge.
Quand l'accumulateur est chargé à pleine capacité, un bouillonnement de l'électrolyte annonce que l'hydrogène se dégage à la plaque négative et l'oxygène à la plaque positive.
L'électrolyte atteint sa densité maximum ; les plaques positives sont de nouveau transformées en peroxyde de plomb (PbO2) et les plaques négatives en plomb pur (Pb). L'accumulateur est prêt à débiter du courant.
Vérification d'un accumulateur
Dès réception d'un accumulateur, on doit procéder à une vérification.
On l'examinera d'abord extérieurement, afin de déceler des dommages durant le transport.
Des points humides sur le fond ou sur les côtés indiquent parfois une fissure.
Dans ce cas on prendra immédiatement les mesures propres, si possible, à y remédier. On vérifie ensuite la hauteur de l'électrolyte.
Avant d'utiliser un accumulateur il est toujours préférable de le charger à pleine capacité. La charge doit être lente (de 3 heures à 6 heures) et on la contrôlera avec des appareils spéciaux.
On veillera particulièrement à ce que la borne positive de l'accumulateur soit reliée au pôle positif de la source et la borne négative au pôle négatif. Un branchement défectueux ou inversé peut mettre l'accumulateur hors d'usage.
Si la densité de l'électrolyte est inférieure à la densité normale on remplacera une petite quantité de celui-ci par un électrolyte de densité 1400 ; on rechargera pendant une demi-heure à une heure et l'on répétera l'opération jusqu'à ce que la densité reste constante.
Au cours de la charge, la température ne doit jamais devenir supérieure à 110°F.
On maintiendra toujours les contacts parfaitement propres, afin d'assurer une bonne conductibilité.
On évitera leur corrosion en les enduisant de vaseline.
Les vibrations excessives ou les chocs risquent de briser un accumulateur ; aussi s'assurera-t-on, dans les endroits où des vibrations peuvent se produire (automobiles, par exemple), que l'accumulateur est solidement fixé sur son cadre métallique.
Pour cette même raison on utilise des branchements flexibles. Les bouchons doivent être bien serrés, afin d'éviter une perte d'électrolyte qui provoquerait aussi la corrosion des contacts.
Après un usage prolongé, on recharge toujours un accumulateur et, de toute façon, on ne laissera jamais la force électromotrice tomber au-dessous de 1.75 volt, car il se formerait un dépôt insoluble de sulfate de plomb (sulfatation).
On procède chaque semaine à une vérification et à un nettoyage pour enlever poussières et saletés qui ont pu se déposer sur le couvercle ; au besoin, on lave le bac avec de l'eau pure et on l'essuie aussitôt.
Tous les mois on ajoute à l'eau de l'ammoniaque ou du bicarbonate de soude (soda à pâte) pour neutraliser les effets de l'acide.
Par temps chaud, on complétera chaque jour le niveau de l'électrolyte au-dessus des plaques en laissant toujours l'espace nécessaire pour l'évaporation des gaz. Trop d'eau diminue la densité de l'électrolyte et par conséquent la capacité de l'accumulateur.
N'utiliser que de l'eau distillée très propre que l'on conservera dans des récipients en verre ou en porcelaine soigneusement bouchés.
Pour assurer un bon mélange, on ajoute toujours l'eau avant l'utilisation ou la recharge de l'accumulateur. Une consommation excessive d'eau indique très souvent une surcharge.
Électrolyte
On trouve chez les fabricants une solution d'acide sulfurique et d'eau distillée de densité 1400 que l'on réduit, selon les besoins, en ajoutant de l'eau distillée.
Plus la densité maximum d'un électrolyte est faible, plus l'accumulateur durera longtemps ; en effet, la réaction chimique sur les plaques négatives étant moins rapide et la charge des plaques positives moins élevée, la détérioration est plus lente.
Par contre, un électrolyte très dense, possédant plus de capacité et donnant plus de voltage, permet de réduire le poids et les dimensions, donc le prix de l'accumulateur.
Sur les automobiles, les avions, etc., où l'on ne dispose que d'un espace et d'un poids réduits, la densité est de 1280 environ.
Le climat conditionne aussi la densité à donner à l'électrolyte.
En été ou dans les pays chauds, on abaissera la densité à 1250, ou même à 1210, de manière à compenser l'accélération de la réaction chimique provoquée par la chaleur. Celle-ci, en augmentant la capacité de l'accumulateur permet l'emploi d'un électrolyte moins dense.
Dans les climats très froids, on augmentera, au contraire, la densité de l'électrolyte pour éviter qu'il ne gèle.
La diminution de la densité spécifique est la conséquence de l'action chimique de l'acide sulfurique sur les plaques pendant le fonctionnement de la batterie.
Plus la quantité d'électrolyte est grande, moins la densité spécifique s'abaisse ; par exemple, pour une petite quantité d'électrolyte, elle passera de 1280 à 1100, alors que pour une grande quantité, elle s'abaissera seulement de 1210 à 1180.
Le tableau suivant donne les proportions d'eau distillée suivant la densité spécifique à obtenir, la densité de l'acide sulfurique (1835) ou celle de la solution (1400).
La dernière colonne indique la température de congélation correspondant à une densité déterminée.
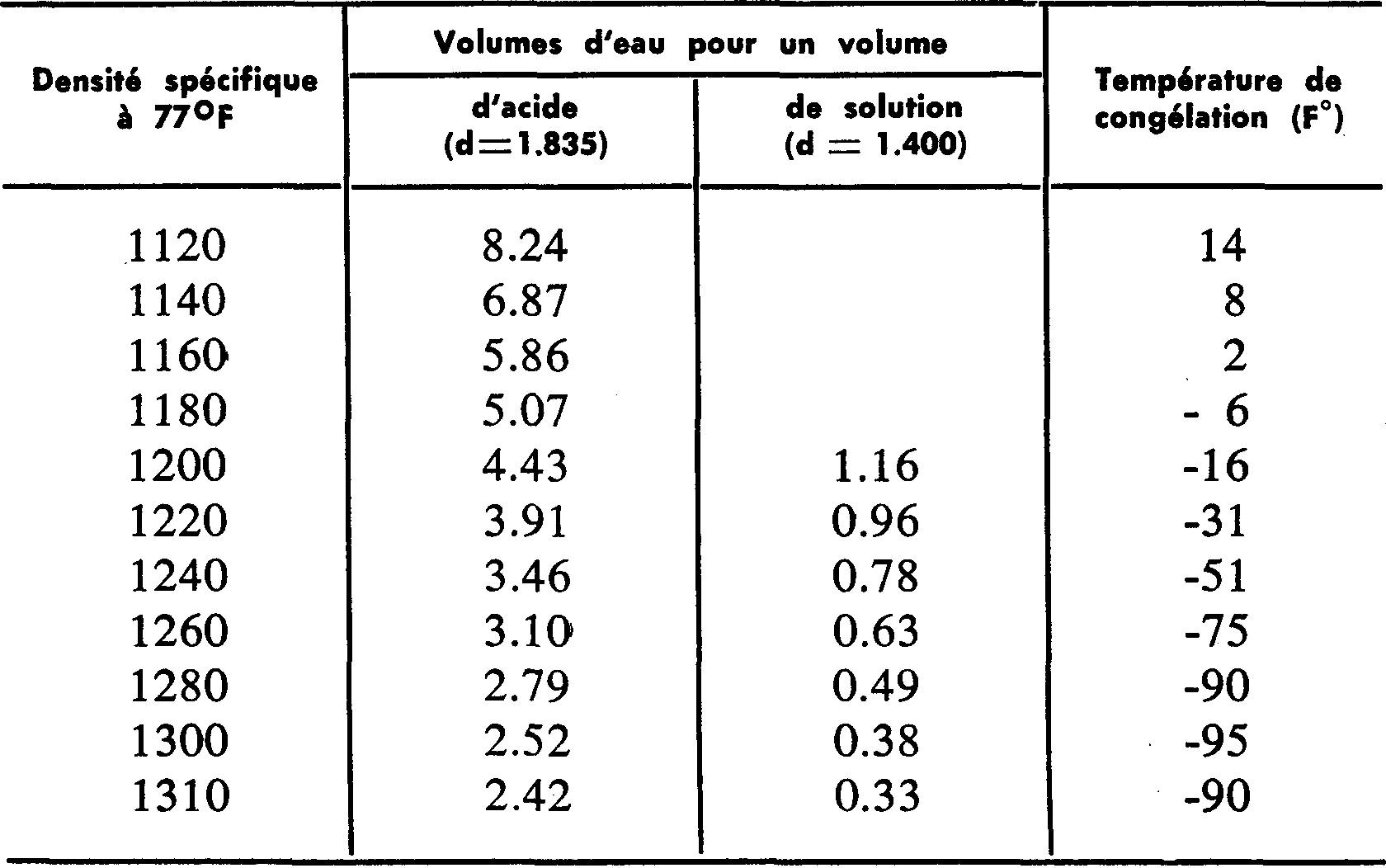
Lorsque l'électrolyte d'un accumulateur chargé n'atteint pas sa densité spécifique, on peut lui faire retrouver une valeur normale en lui ajoutant un électrolyte plus dense.
Avec un écart de 15 unités seulement, on ajoutera, au lieu d'eau distillée, un électrolyte de densité 1300.
Avec un écart supérieur à 15 unités, il convient d'enlever un peu de l'électrolyte trop faible et de le remplacer par un électrolyte de densité 1400.
Dans ce dernier cas, comme nous l'avons dit plus haut, il faut charger l'accumulateur avec un courant d'une intensité peu élevée, pendant une heure environ ; les gaz, en se dégageant, agitent et mélangent la solution.
Si la densité de l'électrolyte d'un accumulateur chargé est, au contraire, plus élevée que la densité spécifique, il est facile de l'abaisser en remplaçant un peu d'électrolyte par de l'eau distillée.
Il faut se souvenir qu'une densité supérieure à 1310 est nuisible à un accumulateur et si l'accumulateur n'a pas été chargé auparavant elle n'indique pas nécessairement une forte charge.
N.B. En préparant l'électrolyte, on doit verser très lentement et toujours l'acide dans l'eau, jamais l'eau dans l'acide, car la réaction chimique, trop brusque, peut être dangereuse.
On utilise couramment, pour vérifier la densité de l'électrolyte d'un accumulateur, l'hydromètre (fig. 6.11).
Fig. 6.11 Hydromètre (Navpers - Basic electricity)
![]()
Cet instrument se compose d'un tube de verre muni d'une poire et d'un embout en caoutchouc et d'un flotteur constituant l'hydromètre proprement dit. L'embout caoutchouté plonge dans l'électrolyte et la poire sert à aspirer le liquide.
À l'intérieur du tube, l'hydromètre, dont la base est lestée, afin de permettre à l'instrument de demeurer dans la position verticale, permet de déterminer la densité grâce à une échelle graduée.
Le poids de l'hydromètre étant un peu plus léger que le poids d'un égal volume d'eau, l'hydromètre s'enfonce plus ou moins, suivant la densité de l'électrolyte, dans le liquide aspiré dans le tube de verre.
La lecture de l'échelle au niveau du liquide indique la densité spécifique de l'électrolyte lorsque la température est de 80°F.
On ajoute à la lecture 4 unités pour chaque 10° au-dessus et l'on soustrait 4 unités pour chaque 10° au-dessous.
Capacité et intensité
La principale caractéristique d'un accumulateur est sa capacité exprimée en ampères-heure.
Chaque élément possède une force électromotrice (f.é.m.) de 2.2 volts en circuit ouvert, tombant rapidement à 2 volts après la fermeture du circuit.
Le voltage d'un accumulateur dépend du nombre de ses éléments, groupés en séries. La f.é.m. d'un accumulateur de 3 éléments est donc pratiquement de 6 volts.
L'intensité maximum est conditionnée par l'électrolyte, la grandeur et le nombre des plaques (surface totale de matière active), la résistance interne de l'accumulateur.
L'intensité effective dépend de l'état, plus ou moins parfait, de l'accumulateur, de son voltage et de la résistance du circuit extérieur.
La capacité d'un accumulateur représente le nombre total d'ampères qu'il peut débiter dans un laps de temps déterminé, le plus généralement 8 heures. La capacité n'est pas constante et au-delà d'une certaine limite elle diminue quand l'intensité du courant augmente.
Un accumulateur de 120 ampères-heure, par exemple, peut débiter 15 ampères pendant 8 heures, 12 ampères pendant 10 heures, 6 ampères pendant 20 heures, etc., mais si la décharge s'effectue en moins de 8 heures, la réaction chimique devient plus lente que le débit de courant.
L'électrolyte ne pénètre pas assez rapidement dans les électrodes et le nombre total d'ampères-heure diminue.
C'est ainsi que le même accumulateur déchargé en 4 heures seulement ne pourra fournir que 85% environ de sa capacité normale, soit 102 ampères-heure. Déchargé en 20 minutes sa capacité s'abaissera à 40%, soit 48 ampères-heure.
En règle générale, à condition de rester dans la limite du temps normal de décharge, l'intensité du courant fourni est égale au quotient de la capacité par le temps:
I = C / t
formule dans laquelle
C = capacité, exprimée en
ampères-heure
I = intensité du courant, exprimée en ampères
t = durée de
la décharge, exprimée en heures
Entretien
Comme tout appareil, un accumulateur exige de l'entretien et l'on peut dire que sa durée dépend beaucoup plus de celui-ci que du service qu'on lui impose.
Un accumulateur bien entretenu dure plusieurs années ; un mois suffit pour détériorer un accumulateur négligé. Les règles suivantes, très importantes, ont trait à l'entretien d'un accumulateur au plomb.
1 - Vérifier l'accumulateur chaque semaine et le recharger tous les mois.
2 - Recharger au plus tôt un accumulateur déchargé, pour éviter sa sulfatation. Le sulfate qui se forme, sorte d'isolant blanchâtre, devient dur et insoluble.
3 - Recharger toujours à un taux normal.
4-Ne jamais laisser la température dépasser 110°F lorsqu'on procède à une charge rapide et réduire la charge au taux normal si des gaz se produisent.
5 - Maintenir la charge jusqu'à ce que trois lectures consécutives, prises à une demi-heure d'intervalle, indiquent une densité constante. Ne jamais essayer d'atteindre une densité spécifique définie.
6 - Ajouter de l'eau distillée de manière à maintenir l'électrolyte à 3/8 de pouce au-dessus des plaques; quand l'électrolyte baisse au-dessous du bord supérieur des plaques, l'accumulateur se détériore rapidement. L'eau bouillie n'est pas de l'eau distillée.
7 - Ajouter l'eau distillée avant la charge, afin d'assurer un bon mélange avec l'électrolyte.
8 - Ne jamais approcher une flamme d'un accumulateur chargé. Les gaz qui s'en échappent sont explosifs.
9 - Couper toujours le courant avant de débrancher l'accumulateur car l'arc qui se produirait pourrait provoquer une explosion.
10-Ne pas prendre la densité de l'électrolyte immédiatement après avoir ajouté l'eau ; le mélange étant imparfait, l'indication serait fausse.
11-Ne rectifier la densité en ajoutant de l'acide qu'après s'être assuré que cela est nécessaire (densité trop faible avec une batterie complètement chargée).
12-Laisser toujours en place les bouchons d'un accumulateur en charge. Ils empêchent l'électrolyte d'atteindre le dessus du bac tout en permettant aux gaz de s'échapper.
13-Nettoyer les bornes de temps à autre avec de l'ammoniaque ou une forte solution de bicarbonate de soude (soda à pâte). Bien essuyer, puis les enduire de vaseline. Tenir les cosses bien serrées.
14-N'appliquer de fortes charges que pendant une courte période ou relier alors plusieurs accumulateurs en parallèle.
15-Se souvenir que par temps froid un électrolyte de faible densité gèle très facilement.
Utilisation
L'accumulateur au plomb est d'un usage général dans les automobiles où il alimente les appareils tels que le démarreur, le système d'allumage, les phares, etc.
On l'utilise également dans les autobus, les trains, certains canots automobiles et dans les édifices où l'on doit disposer d'une source d'énergie électrique pour pallier les inconvénients, parfois graves, d'une panne de courant, comme par exemple les hôpitaux.
69. Accumulateur Edison
Dans l'accumulateur alcalin fer-nickel Edison les matériaux employés, l'électrolyte et le mode de construction sont totalement différents de ceux d'un accumulateur au plomb.
Les plaques positives (fig. 6.12) sont formées d'un long ruban d'acier perforé de 500 trous par pouce carré, enroulé sur lui-même et étiré pour obtenir un tube que l'on remplit par des couches alternatives d'hydrate de nickel et de grains minuscules de nickel pur ; celui-ci permet d'obtenir une meilleure conductibilité.
6.12 Accumulateur EDISON (plaques positives) (Edison storage batteries division)
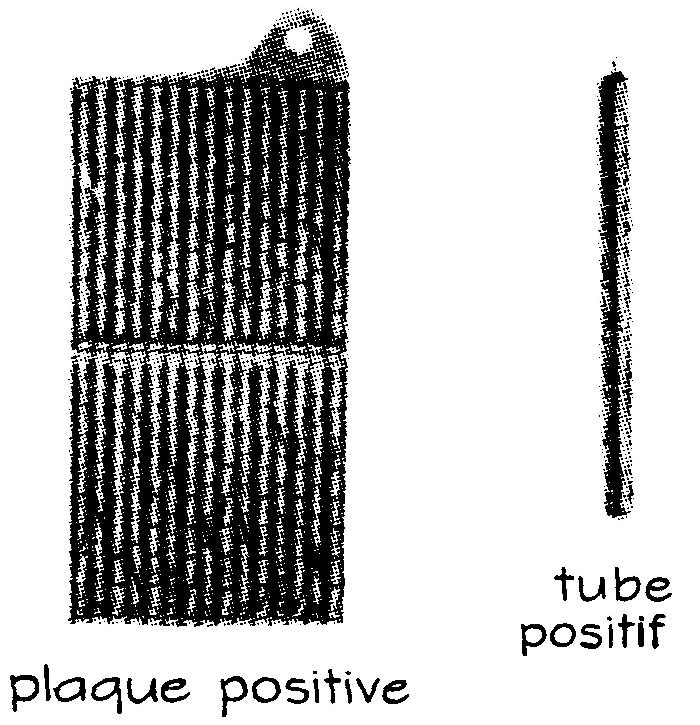
Les tubes sont scellés ensuite par écrasement des extrémités, puis on les monte dans un cadre d'acier. Chaque plaque positive comprend 30 tubes.
Au cours de la première charge,
l'hydrate de nickel se transforme en oxyde de nickel et va constituer la matière
active.
Les plaques négatives (fig. 6.13) sont formées de 24 cadres
d'acier au nickel dans lesquels on fixe de petites boîtes en tôle d'acier
perforée appelées "pochettes" ; ces pochettes dont le nombre atteint 1,900 par
pouce carré sont remplies d'oxyde de fer, puis embouties à la presse hydraulique
pour assurer un bon contact.
6.13 Accumulateur EDISON (plaques négatives) (Edison storage batteries division)
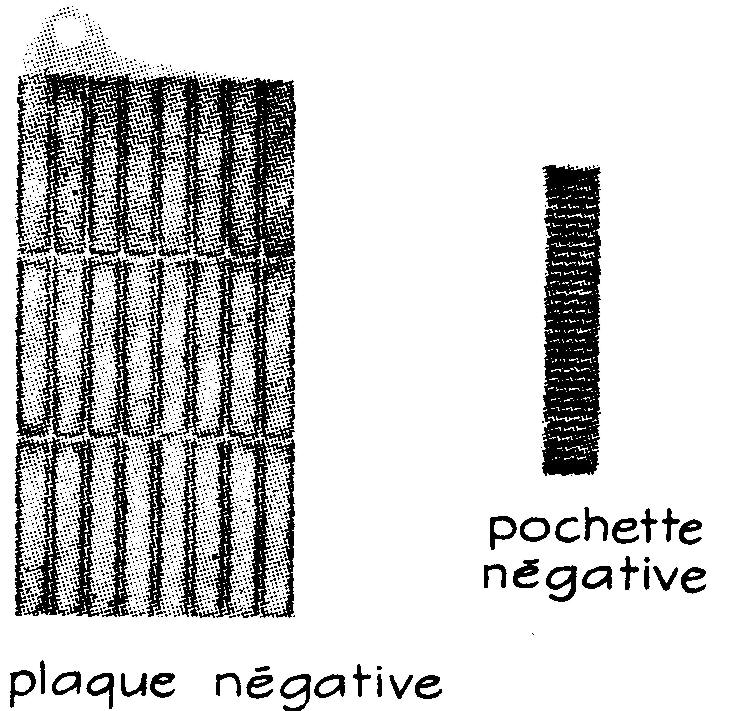
Les plaques positives sont groupées en enfilant leurs cadres, espacés par des rondelles en acier nikelé, sur une tige.
Cette tige, solidement maintenue par des écrous, porte la borne positive. Les plaques négatives dont le nombre est égal à celui des bornes positives plus une sont groupées de la même façon et la tige porte la borne négative (fig. 6.14).
Fig. 6.14 Coupe d'un accumulateur EDISON (Edison storage batteries division)
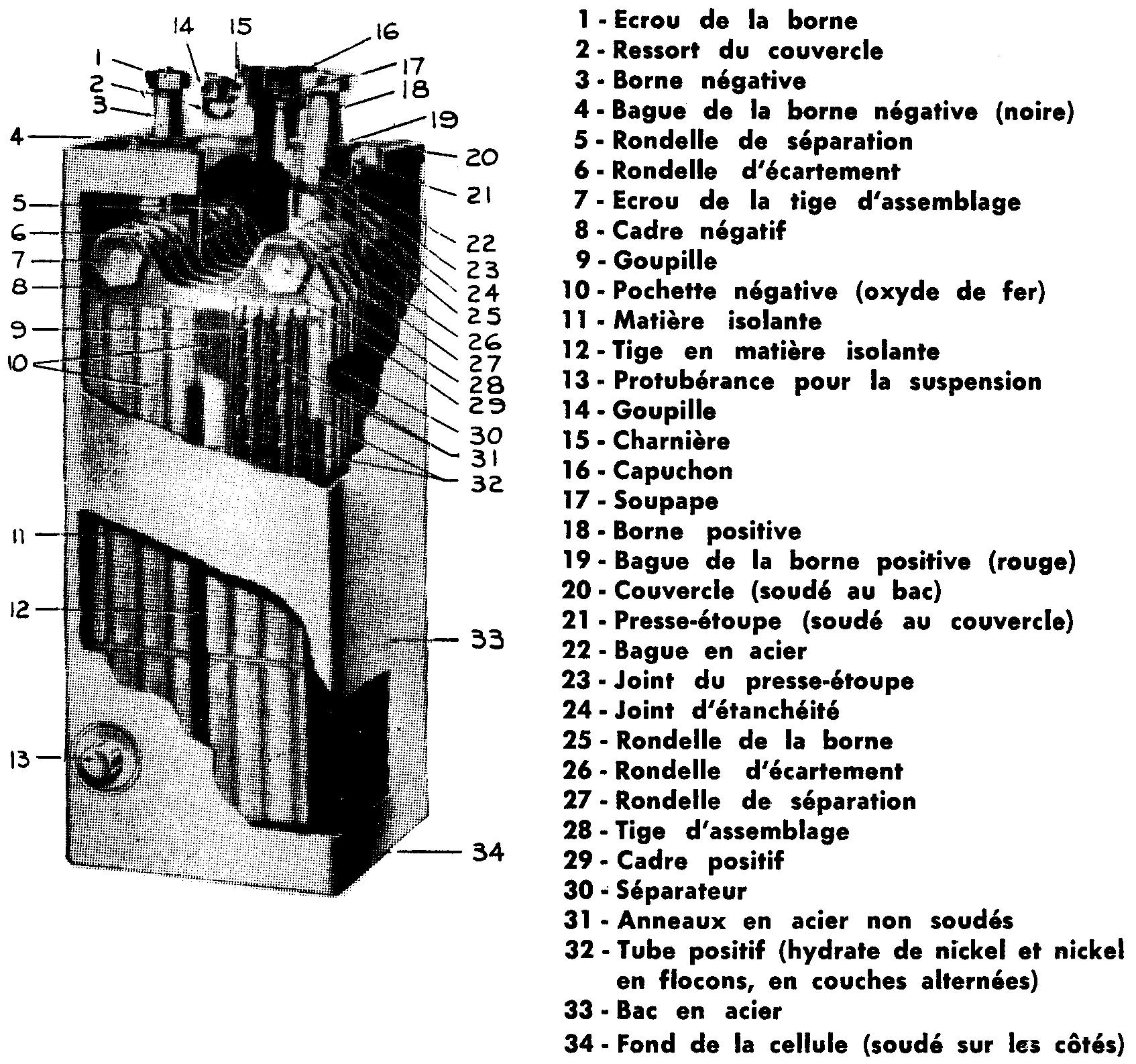
On emboîte alors les deux éléments l'un dans l'autre, chaque plaque positive étant encadrée par deux plaques négatives ; on isole l'ensemble du bac par des tiges d'ébonite.
Le bac, en acier fortement nickelé, est absolument étanche et n'offre qu'une ouverture fermée par un bouchon perforé afin de permettre l'évacuation des gaz.
L'électrolyte consiste en une solution alcaline de soude caustique ou de potasse, de densité 1200 environ ; contrairement aux électrolytes acides, il ne prend aucune part active à la réaction chimique ; il la facilite seulement et, pour cette raison, sa densité restera toujours constante.
Principe et fonctionnement
Le principe de l'accumulateur Edison repose sur l'oxydation et la réduction de métaux non solubles dans un électrolyte de potasse ou de soude caustique à 21% ajoutée à de l'hydrate de lithium.
Le courant continu décompose l'électrolyte qui se reconstitue immédiatement par une deuxième réaction et conserve ainsi une densité constante.
Le courant de charge de l'accumulateur change l'hydrate de nickel en oxyde de nickel.
L'oxyde de fer de la plaque négative est réduit en fer pur. Dans l'accumulateur chargé la plaque positive est donc en oxyde de nickel et la plaque négative en fer pur.
Pendant la décharge, le matériel actif de la plaque positive, l'oxyde de nickel, est réduit en hydrate de nickel; le fer pur de la plaque négative est réduit en oxyde de fer.
Les réactions se résument donc en un transfert d'oxygène de la plaque négative à la plaque positive au cours de la charge et, inversement, de la plaque positive à la plaque négative au cours de la décharge.
Ces réactions sont assez compliquées, mais peuvent être schématisées par l'équation suivante :
FeO + 2NiO ⇔ Fe + Ni2O3
Les flèches indiquent la réversibilité. La réaction de la charge se lit de la gauche vers la droite et la réaction de la décharge de la droite vers la gauche.
L'accumulateur Edison ne possède qu'une f.é.m. de 1.2 volt et son prix d'achat est environ deux fois plus élevé que celui d'un accumulateur au plomb, mais ces inconvénients sont largement compensés par de nombreux avantages.
a) Poids relativement faible.
b) Capacité constante quel que soit le régime.
c) Entretien économique.
d) Bonne résistance aux chocs et trépidations.
e) Absence de vapeurs corrosives.
f) Tolérance des écarts de régime et des basses températures (-40°F.).
g) Recharge rapide.
Pour obtenir un bon rendement, il faut le recharger dès que la tension atteint 0.9 volt et compenser l'évaporation avec de l'eau distillée.
Utilisation
Les usages des accumulateurs Edison sont sensiblement les mêmes que ceux des accumulateurs au plomb, mais ils conviennent particulièrement bien pour les centrales électriques isolées, pour le téléphone, le télégraphe, les systèmes d'alarme, les signaux automatiques des passages à niveau, les véhicules électriques, etc.
70. Résistance interne des piles et accumulateurs
Un voltmètre relié aux bornes d'une pile ou d'un accumulateur en indique la force électromotrice E, sans débit de courant (circuit ouvert).
Dès que l'on relie le circuit extérieur aux bornes, on s'aperçoit que la force électromotrice diminue.
La chute de tension aux bornes provient de ce que la résistance intérieure r de la source s'oppose au passage du courant.
La perte de tension sert à vaincre la résistance intérieure et varie suivant l'état de la pile ou de l'accumulateur.
Elle est proportionnelle à l'intensité du courant débité, limité par la résistance intérieure r de la pile ou de l'accumulateur, et par la résistance R du circuit extérieur.
Le voltage réel ou tension aux bornes en circuit fermé dépend de l'intensité du courant et la résistance intérieure r.
E = Ir
71. Montage en série ou en tension
Dans le montage en série (fig. 6.15), on relie le pôle positif du premier élément au pôle négatif du second ; le pôle positif du second élément au pôle négatif du troisième élément, et ainsi de suite.
Le pôle négatif du premier élément et le pôle positif du dernier élément constituent les pôles du groupement ainsi formé.
Fig. 6.15 Montage en série
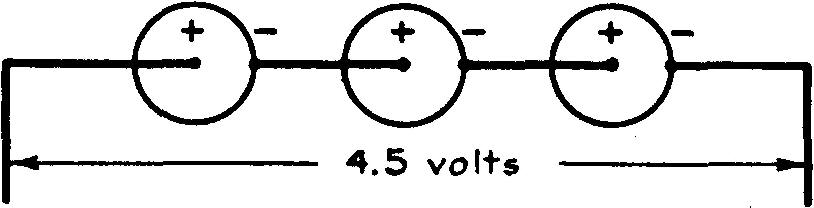
Dans un tel montage, les forces électromotrices de chaque élément s'additionnent de même que les résistances intérieures ; le régime du courant conserve la même valeur que celui d'une seule pile.
Avec n éléments en série, chacun de force électromotrice E et de résistance intérieure r, reliés à un circuit extérieur de résistance R, l'intensité du courant est de:
I = nE / (R + nr)
Application 6.01
On relie huit piles en série. On demande quelle est l'intensité du courant débité si la force électromotrice et la résistance intérieure de chaque pile sont respectivement 1.5 volt et 1 ohm et la résistance du circuit extérieur 25 ohms.
Solution
Voltage total: 1.5 X 8 = 12 volts
Résistance intérieure totale: 1X8 = 8 ohms
Résistance totale: 25 + 8 = 33 ohms
Intensité du courant: 12 volts / 33 ohms = 0.363 ampère.
72. Montage en parallèle ou en quantité
Dans le montage en parallèle, appelé aussi en dérivation (fig. 6.16), on relie tous les pôles positifs d'une part et tous les pôles négatifs d'autre part.
Fig. 6.16 Montage en parallèle
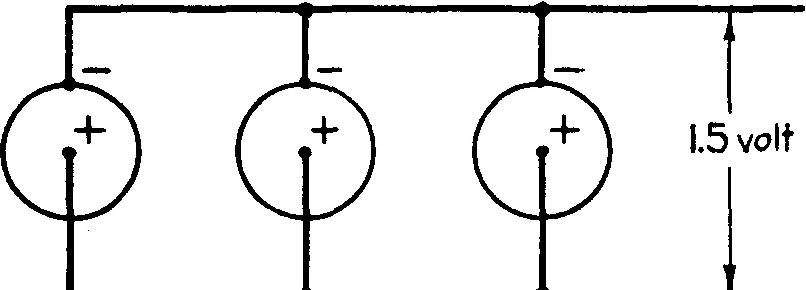
La batterie ainsi constituée ne possède que la force électromotrice d'un seul élément, mais chaque élément débite son courant dans une dérivation et l'intensité maximum augmente proportionnellement au nombre n d'éléments.
Ttandis que la résistance intérieure du groupement diminue proportionnellement à ce même nombre ; elle est égale à la nième partie de la résistance intérieure d'une seule pile, soit:
r / n
La batterie étant reliée à un circuit extérieur de résistance R, l'intensité du courant est donnée par la formule
I = E / (R + r/n)
Application 6.02
On groupe en parallèle huit piles. Chacune d'elles a une force électromotrice de 1.5 volt et une résistance intérieure de 1 ohm. Sachant que la résistance du circuit extérieur est de 25 ohms, quelle sera l'intensité du courant?
Solution
Voltage de la batterie = 1.5 volt — le même que dans chaque pile.
Résistance intérieure de la batterie = r/n = 1/ 8 = 0.125 ohm.
Résistance totale du circuit = 25 + 0.125 = 25.125 ohms.
Intensité du courant: 1.5 volt / 25.125 ohms = 0.059 ampère.
73. Montage mixte
Lorsqu'on veut augmenter à la fois la f.é.m. et l'intensité du courant d'une
batterie on utilise le montage mixte. On groupe les n éléments de la batterie en
m séries parallèles comprenant chacune p éléments (fig. 6.17).
Fig. 6.17 Montage mixte (séries parallèles)
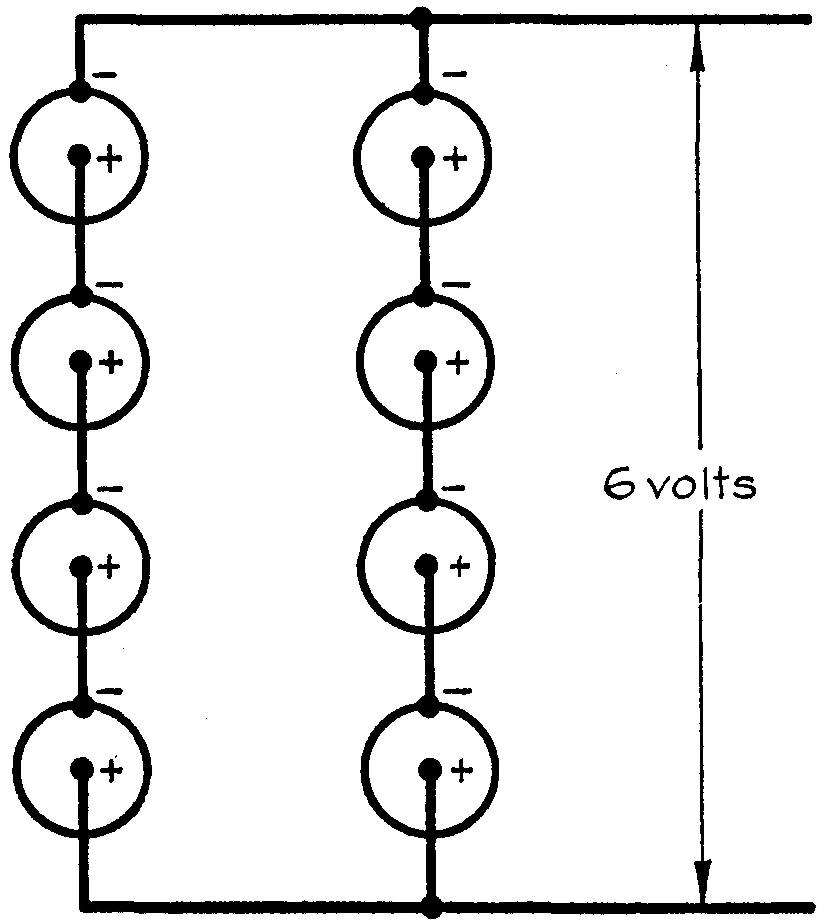
La force électromotrice de la batterie est pE volts et sa résistance intérieure est Pr/m.
Lorsque la batterie est reliée à un circuit extérieur de résistance R l'intensité du courant est:
I = pE / (R + pr/m) = mpE / (mR+pR)
Application 6.03
On groupe 8 piles de 1.5 volt en deux séries parallèles de 4 piles chacune. La résistance intérieure d'une pile est de 1 ohm et la résistance du circuit extérieur, de 25 ohms. Quelle est l'intensité du courant?
Solution
p = 4
m = 2
I = (2 X 4 X 1.5) / ((2 X 25) + (4 X 1)/2) = 0.222 ampère
Voltage total: 1.5 X 4 = 6 volts
La résistance totale intérieure = (1 x 4) / 2 = 2 ohms
La résistance totale du circuit: 25 + 2 = 27 ohms
L'intensité du courant est: 6 volts / 27 ohms = 0.222 ampère
Dans les trois exemples précédents, nous avons à dessein conservé le même nombre de piles, ainsi que les mêmes caractéristiques de voltage et de résistances.
La comparaison des résultats obtenus permettra de mieux comprendre l'avantage que présentent les différents groupements.
QUESTIONNAIRE Les réponses ne sont pas données
1. Définir : batterie, pile primaire, pile secondaire, électrodes, électrolyte, matière active.
2. De quoi dépend la force électromotrice d'une pile?
3. Décrire brièvement la pile de Volta.
4. Expliquer le fonctionnement de la pile de Volta.
5. Qu'est-ce que la polarisation?
6. Décrire brièvement la pile Leclanché; la pile sèche.
7. Quels sont les trois facteurs dont dépend la résistance d'une pile?
8. Quels sont les éléments de la pile sèche?
9. Quelles sont les caractéristiques d'une pile?
10. Quelle différence existe entre la pile primaire et la pile secondaire?
11. Quelle est la condition essentielle d'une pile secondaire de bonne qualité?
12. Comment est constitué l'accumulateur au plomb?
13. Expliquer le fonctionnement de l'accumulateur au plomb.
14. Pourquoi l'accumulateur au plomb doit-il être préalablement chargé afin qu'il puisse fournir du courant?
15. Pourquoi ne doit-on pas décharger complètement un accumulateur au plomb?
16. Quelle eau doit-on mettre dans un accumulateur, et quelle précaution doit-on prendre pour la conserver?
17. Quand faut-il ajouter de l'eau distillée?
18. Quelle est la composition de l'électrolyte d'un accumulateur au plomb?
19. Quel est l'influence de l'électrolyte sur la durée et la capacité d'un accumulateur au plomb?
20. Quels sont les trois facteurs qui influent sur la densité de l'électrolyte?
21. Comment augmenter la densité de l'électrolyte?
22. Comment abaisser la densité de l'électrolyte?
23. Décrire un hydromètre. Quelle est son utilisation?
24. Comment assurer le bon entretien d'un accumulateur?
25. De quoi dépend la capacité d'un accumulateur?
26. Comment déterminer la durée de charge d'un accumulateur?
27. De quoi dépend la conservation d'un accumulateur au plomb?
28. Quels sont les usages de l'accumulateur au plomb?
29. Décrire brièvement l'accumulateur Edison.
30. Expliquer brièvement le fonctionnement de l'accumulateur Edison.
31. Quels sont les avantages et les inconvénients de l'accumulateur Edison?
32. Quels sont les usages de l'accumulateur Edison?
33. De quelles manières groupe-t-on des piles entre elles, et dans quel but?
34. Indiquer la formule de l'intensité du courant dans les différents montages.
PROBLÈMES
6.01 — On dispose de quatre piles sèches de 1.5 volt et d'une résistance intérieure de 0.06 ohm. Relier successivement toutes ces piles en série, puis toutes en parallèle et dans chaque cas, calculer :
a) l'intensité du courant débité par une seule pile en court-circuit;
b) l'intensité du courant débité par les quatre piles reliées en série et en court-circuit;
c) l'intensité du courant débité par une seule pile reliée à un circuit extérieur de 0.18 ohm de résistance;
d) l'intensité du courant débité par les quatre piles reliées en série et ayant la même résistance comme circuit extérieur;
e) l'intensité du courant débité par les quatre piles reliées en parallèle et ayant la même résistance comme circuit extérieur.
6.02 — Un conducteur dont la résistance est de 14 ohms est en série avec une pile dont la résistance intérieure est de 1 ohm et la force électromotrice de 1.5 volt.
On demande le voltage entre les bornes de la pile.
6.03 — Deux conducteurs ayant respectivement 4 ohms et 7 ohms de résistance sont en série avec une pile de résistance intérieure 1 ohm et de force électromotrice 2.4 volts.
On demande le voltage a) entre les extrémités de chaque conducteur b) entre les bornes de la pile.
6.04 — La résistance intérieure d'un accumulateur de 6 volts est de 0.01 ohm et l'intensité du courant débité 35 ampères.
Quel est a) la perte intérieure de voltage b) le voltage aux bornes?
6.05 — Combien de piles de 1.5 volt en série seront nécessaires pour obtenir un voltage total de 18 volts?
6.06 — Si la charge d'une pile ne doit pas dépasser 5 ampères sous 1.5 volt, trouver le nombre de piles nécessaires et le genre de montage pour un courant de 35 ampères sous 6 volts de tension.
6.07 — Une batterie d'accumulateurs comprend 20 éléments d'une force électromotrice de 2 volts et d'une résistance intérieure de 0.1 ohm chacun. On les monte en série.
Calculer l'intensité du courant du circuit si l'on relie les pôles de la batterie à une résistance de 8 ohms.
6.08 — On dispose de 30 éléments d'une force électromotrice de 2 volts et d'une résistance intérieure de 2.5 ohms chacun. On les groupe en 5 séries parallèles de 6 éléments chacune.
Trouver l'intensité du courant débité à travers une résistance extérieure de 45 ohms.
6.09 — Quelle est l'intensité du courant maximum débité à travers une résistance de 6 ohms, si l'on dispose de 40 piles d'une résistance intérieure de 0.25 ohm et d'une force électromotrice de 2 volts chacune?
6.10 — On relie 20 piles ayant chacune une force électromotrice de 2 volts et une résistance intérieure de 1 ohm en 2 séries parallèles de 10 piles chacune.
Calculer l'intensité du courant débité à travers une résistance de 3 ohms.
6.11 —Quelle est l'intensité du courant fourni par un élément de 1.5 volt et d'une résistance intérieure de 0.3 ohm, quand on le relie à une résistance extérieure de 0.7 ohm?
6.12 — Une pile usagée et court-circuitée donne 0.25 ampère sous 1 volt.
Quelle est sa résistance intérieure?
6.13 — Une pile de 20 volts possède une résistance intérieure de 0.5 ohm.
Quelle est l'intensité du courant débité à travers une résistance de 3.5 ohms?
6.14 — Une pile de 10 volts et d'une résistance intérieure de 2 ohms, débite un courant de 0.5 ampère.
Quelle est la résistance du circuit extérieur?
6.15 — Une pile de 1.8 volt reliée à une résistance de 3 ohms débite un courant de 0.5 ampère.
Quelle est la résistance intérieure de cette pile?
6.16 — La force électromotrice d'un accumulateur est de 6.4 volts et sa résistance intérieure de 0.6 ohm.
Quel est le voltage aux bornes si elles sont reliées à un fil de un ohm de résistance?
6.17 — Quelle est l'intensité du courant et la tension aux bornes d'une pile de 1.5 volt et d'une résistance intérieure de 0.15 ohm si elle débite dans une résistance extérieure de 2.35 ohms?
6.18—Un accumulateur est formé de 25 éléments de 2.2 volts chacun.
Quelle est la force électromotrice de l'accumulateur?
6.19 — Une pile en court-circuit débite un courant de 25 ampères. Le voltage aux bornes est de 1.5 volt. Calculer sa résistance intérieure.
