Nature de l'électricité
Afin de comprendre la nature et l'origine de l'électricité, on doit examiner la structure même de la matière. Dans cette section, nous étudierons les propriétés élémentaires des électrons et leur distribution à l'intérieur d'un corps.
Nous verrons aussi les propriétés des protons et des neutrons, ainsi que la composition atomique de quelques éléments utilisés en électrotechnique.
Nature de la matière
Prenons un bloc d'aluminium et coupons-le en deux. Reprenons une des parties et séparons-la également en deux.
Si nous continuons ce procédé de fractionnement des milliers et des milliers de fois, nous atteindrons une limite où il ne sera plus possible de subdiviser la particule d'aluminium extrêmement petite ainsi obtenue, sans en changer les propriétés caractéristiques, c'est-à-dire sans modifier la nature même de l'aluminium.
Cette dernière particule est appelée atome. La matière est ainsi composée d'atomes dont la structure particulière caractérise les différents éléments tels que l'aluminium, le carbone, le cuivre, l'hydrogène, l'oxygène, etc.
Dans la plupart des substances, cependant, la plus petite particule qui conserve toutes les propriétés originales est la molécule.
Une molécule est un groupement de deux, trois, quatre, parfois jusqu'à des milliers d'atomes.
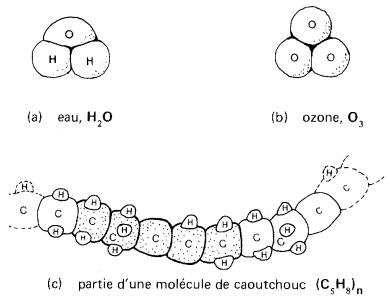
La molécule d'eau, par exemple, est formée de deux atomes d'hydrogène et d'un atome d'oxygène. La molécule d'ozone, un gaz libéré lors d'une décharge électrique, est composée de 3 atomes d'oxygène.
Enfin, la molécule de caoutchouc contient une chaîne d'au moins 5000 atomes de carbone et 8000 atomes d'hydrogène (Fig. 2-1).
Figure 2-1 Représentation des molécules d'eau, d'ozone et de caoutchouc avec leurs formules. La molécule de caoutchouc est formée d'une longue chaîne de groupements C5H8, ce qui lui confère sa souplesse.

Si l'on fractionnait un échantillon de caoutchouc comme on l'a fait pour l'aluminium, il faudrait, rendu au stade de la molécule, arrêter la subdivision, sans quoi les propriétés de la particule subdivisée ne seraient plus les mêmes que celles de l'échantillon initial.
Attraction entre atomes et molécules
Les atomes et les molécules s'attirent avec une force gravitationnelle identique à celle qui attire une pomme vers la terre. La force d'attraction augmente à mesure que les molécules se rapprochent, mais elle demeure faible à moins que les molécules soient très serrées les unes contre les autres.
Les molécules d'un gaz sont relativement éloignées les unes des autres ; par conséquent, les forces d'attraction sont négligeables, ce qui explique leurs mouvements indépendants et désordonnés.
Par contre, les atomes d'un corps solide sont tellement rapprochés les uns des autres que la force d'attraction devient très grande, ce qui donne au corps cette rigidité que l'on connaît.
Contrairement aux molécules d'un gaz, les molécules (ou atomes) d'un corps solide ne sont pas libres de se déplacer, mais demeurent figées sur place. Elles vibrent seulement dans leur position captive, l'amplitude des vibrations augmentant avec la température.
Si la température est suffisamment élevée, les vibrations intenses réussissent à éloigner les molécules les unes des autres, de sorte que les forces d'attraction ainsi affaiblies transforment le solide dur en liquide.
Structure atomique
S'il était possible de le voir, on constaterait que tout atome est composé d'un noyau très petit, très lourd et portant une charge électrique positive (+) autour duquel tournent à une très haute vitesse des électrons portant des charges négatives (-).
La charge totale des électrons neutralise la charge positive du noyau de sorte que l'atome est, dans son ensemble, électriquement neutre.
L'atome peut être comparé au système solaire, dans lequel le soleil remplit le rôle du noyau et les planètes, celui des électrons.
C'est un fait vérifié expérimentalement que les corps chargés électriquement donnent naissance à des effets d'attraction et de répulsion. Les charges électriques de même signe se repoussent tandis que les charges de signe contraire s'attirent.
On conçoit donc qu'il existe des forces d'attraction électriques entre le noyau (+) et les électrons (-) d'un atome; cette force sera d'autant plus grande que les électrons seront plus près du noyau.
L'atome d'aluminium est représenté schématiquement à la Fig. 2-2.
Figure 2-2 Structure simplifiée de quelques atomes
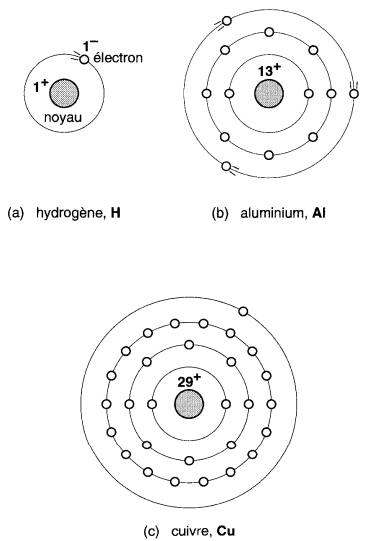
Il comporte un noyau central autour duquel gravitent 13 électrons sur des orbites définies (représentées par des traits pointillés).
Ces électrons sont répartis en couches concentriques comme suit : la couche interne est complète avec deux électrons, la couche intermédiaire est très compacte et très stable avec huit électrons, enfin la couche périphérique ne compte que trois électrons.
Toute substance est ainsi formée d'un ensemble d'atomes.
La constitution de ces atomes varie d'un corps à l'autre, le noyau étant plus ou moins lourd et les électrons, plus ou moins nombreux. (Voir l'atome de cuivre et l'atome d'hydrogène, Fig. 2-2.)
Dimensions de l'atome
Même si l'atome est extrêmement petit, on a pu néanmoins, par des procédés ingénieux, évaluer ses dimensions, son poids et sa charge électrique.
L' atome d'aluminium est tellement petit qu'il faudrait en mettre environ 100 millions bout à bout pour former une chaîne d'une longueur égale à un centimètre.
L'atome le plus simple est celui de l'hydrogène parce qu'il ne comporte, autour de son noyau, qu'un seul électron.
L'exemple suivant nous permet de fixer les dimensions relatives du noyau et de l'électron. Imaginons qu'on puisse grossir un atome d'hydrogène 100 millions de millions (100 x 106 x 106) de fois.
On pourrait alors représenter le noyau de l'atome par un grain de sel et l'électron par une balle légère de 10 cm de diamètre, tournant autour de ce noyau à une distance d'environ 5 kilomètres.
D'après cet exemple, on réalise que la plus grande portion de l'atome est vide. En effet, s'il était possible de comprimer les électrons et les noyaux ensemble, on pourrait placer toute la matière d'une grande ville dans une boîte d'allumettes.
Si on ne peut pas toujours voir à travers un corps, qui pourtant est formé d'atomes si vides, c'est que les rayons lumineux sont déviés par les atomes.
Électrons libres
Revenons maintenant à l'atome d'aluminium de la Fig. 2-2.
On a vu qu'il n'y a que trois électrons sur l'orbite extérieure. Ces trois électrons, étant très peu retenus par le noyau, sont relativement libres et, dans un échantillon d'aluminium, ils sautent continuellement d'un atome à un autre dans toutes les directions (Fig. 2-3).
Figure 2-3 Les électrons libres à l'intérieur d'un morceau d'aluminium sautent continuellement d'un atome à l'autre
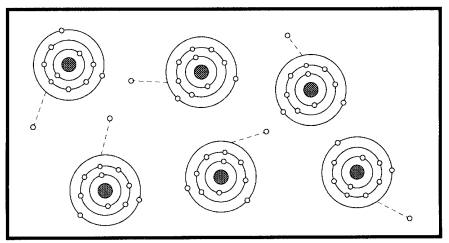
On les appelle électrons libres par opposition à ceux qui restent liés au noyau. Ces électrons libres se déplacent avec une très grande mobilité dans les espaces entre les atomes et, dans leur mouvement désordonné, frappent les atomes avoisinants.
Leur vitesse est de l'ordre de 1000 kilomètres par seconde. Cependant, même si, dans un bloc de métal, ils sont en constante agitation, ils ne quittent pas le métal. Comme le nombre total de noyaux et d'électrons ne change pas, le bloc de métal sera électriquement neutre.
La Fig. 2-3 n'est évidemment pas à l'échelle car un centimètre cube d'aluminium compte plus de 1022 électrons libres.
Si maintenant, par un procédé quelconque, on arrache un certain nombre d'électrons au bloc de métal, la charge positive des noyaux ne sera plus exactement équilibrée par la charge négative des électrons, de sorte que la charge électrique résultante du bloc sera positive (+).
Inversement, quand on ajoute des électrons à un bloc de métal originellement neutre, l'excédent d'électrons lui donnera une charge résultante négative (-).
En somme, un corps devient positif ou négatif suivant qu'il y a manque ou surabondance d'électrons.
Conducteurs et isolants
Les corps métalliques comme le cuivre et l'aluminium ne possèdent respectivement qu'un et trois électrons périphériques dans leur atome. Ces corps peuvent abandonner très facilement ces électrons ou en recevoir d'autres aussi facilement, et sont donc d'excellents véhicules d'électrons.
On les appelle conducteurs. Il n'en est pas ainsi des corps, comme le caoutchouc, dont les électrons sont retenus énergiquement à leurs noyaux par des forces considérables. Ces corps n'ont pratiquement pas d'électrons libres, et ils sont nommés isolants.
La quantité d'électrons libres est précisément ce qui distingue les corps bons conducteurs d'électricité des isolants; les électrons se déplacent facilement dans les conducteurs, difficilement dans les isolants.
Un isolant parfait, interposé entre deux conducteurs, s'oppose à tout échange d'électrons entre eux.
Distribution des électrons libres
Ordinairement, les électrons libres à l'intérieur d'un barreau d'aluminium sont répartis uniformément, de sorte que chaque millimètre de sa longueur soit électriquement neutre (Fig. 2-4a).
Figure 2-4
a. Distribution uniforme des électrons libres à l'intérieur d'un barreau métallique.
b. Distribution non uniforme des électrons libres.
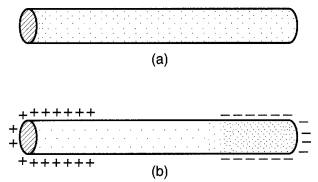
Mais imaginons que l'on puisse, par un moyen quelconque, chasser un grand nombre d'électrons vers une extrémité du barreau, celle-ci deviendra négative. L'autre extrémité, privée de ses électrons habituels, aura une charge nette positive (voir Fig. 2-4b).
Le barreau aura donc des extrémités positive et négative bien que, dans son ensemble, il demeure neutre, n'ayant ni perdu ni gagné d'électrons.
Mais cette distribution inégale des électrons est anormale et l'équilibre sera rétabli dès que l'influence extérieure qui a provoqué la migration aura disparu.
Sources d'électricité Pour produire (ou générer) de l'électricité, il faut changer le peuplement relatif des électrons entre deux points.
Les dispositifs capables de créer un tel surplus d'électrons à un point et un manque à un autre point sont appelés générateurs ou sources d'électricité. Cette répartition inégale des électrons peut être provoquée de plusieurs manières.
On peut le faire:
1. chimiquement, comme dans les piles et les accumulateurs,
2. mécaniquement, comme dans les dynamos et alternateurs,
3. par effet thermique, comme dans les thermocouples, ou
4. par effet optique, comme dans les cellules photo-électriques.
Dans chaque cas, le point (ou borne) ayant un manque d'électrons possède une charge positive, donc une polarité positive (+). Inversement, le point ayant un surplus d'électrons aura une charge négative, et par conséquent, une polarité négative (-).
Courant électrique Si on relie les deux bornes d'une pile au moyen d'un conducteur (Fig. 2-5), les électrons, en surcroît sur la borne négative, se repousseront mutuellement et chasseront les électrons libres du conducteur vers la borne positive.
Figure 2-5
a. Une pile est un générateur d'électricité.
b. Sens du courant électronique dans un conducteur connecté aux bornes d'une pile.
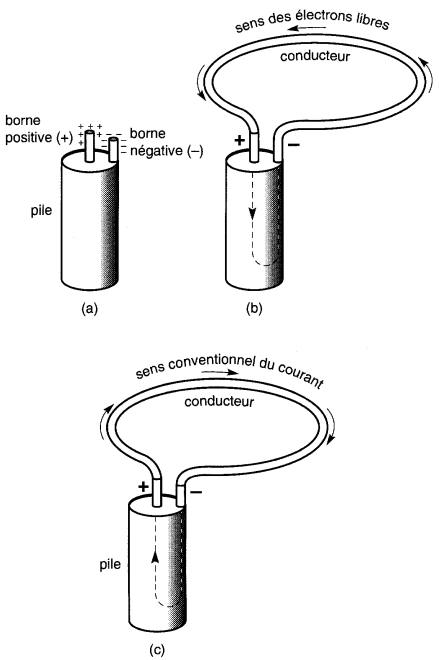
De plus, cette borne positive, présentant un manque d'électrons, attirera énergiquement les électrons libres. Il en résulte un mouvement continuel d'électrons dans le conducteur, de la borne négative à la borne positive.
C'est ce mouvement d'ensemble des électrons libres qui constitue le courant électrique. Le mouvement d'ensemble des électrons est lent car ils rencontrent sur leur passage un très grand nombre de noyaux d'atomes qui les font dévier et les retardent.
Ainsi, la vitesse d'entraînement des électrons dans un conducteur qui alimente une lampe à incandescence de 60 watts sous une tension de 120 volts est seulement de l'ordre de 5 centimètres à l'heure.
Bien que cette vitesse soit très faible, le courant électrique s'établit très vite d'un bout à l'autre d'un conducteur (à une vitesse qui se rapproche de celle de la lumière: 300 000 kilomètres par seconde).
Au moment où l'on raccorde un conducteur à une source d'électricité, des électrons supplémentaires sont introduits à l'une des extrémités du conducteur.
Presque instantanément, les électrons libres localisés à l'autre extrémité sont contraints d'évacuer. C'est un effet de proche en proche : les électrons qui entrent par une des extrémités ne sont pas les mêmes que ceux qui sortent presque aussitôt par l'autre.
C'est grâce à la grande vitesse d'établissement du courant électrique que deux personnes peuvent communiquer presque instantanément au téléphone.
Les électrons mis en branle par la voix d'une personne qui parle à une extrémité de la ligne provoquent aussitôt un mouvement semblable des électrons à l'autre extrémité, de sorte que les deux interlocuteurs peuvent communiquer comme si aucune distance ne les séparait.
La vitesse d'établissement du courant permet aussi la grande rapidité des ordinateurs électroniques qui font leur calculs des millions de fois plus vite que les calculatrices mécaniques d'autrefois.
Toutefois, la vitesse d'établissement du courant électrique n'est pas instantanée: en effet, si l'on pouvait relier la planète Mars et la Terre avec une ligne téléphonique, cela prendrait 20 minutes pour transmettre un message.
Sens du courant
Avant l'établissement de la théorie électronique du courant électrique, certains savants s'étaient imaginés que le courant électrique se déplaçait dans un conducteur extérieur au générateur de la borne positive du générateur à sa borne négative.
Malheureusement, ce sens conventionnel du courant, qui a été choisi arbitrairement, est l'inverse du sens de déplacement des électrons.
Les électrons, dans un conducteur métallique, se dirigent toujours vers la borne positive du générateur. Nous adopterons le sens conventionnel du courant parce qu'il est reconnu universellement.
Il est bon, toutefois, de se rappeler que le sens du courant électronique est, en réalité, inverse du sens conventionnel (voir Fig. 2-5).
En se référant aux Fig. 2-5b et 2-5c, on notera que le courant circule aussi à l'intérieur de la pile. Cependant, le courant conventionnel y circule de la borne négative à la borne positive, ce qui est l'inverse de son cheminement dans le conducteur extérieur.
Protons et neutrons
Jusqu'à maintenant, nous avons considéré le noyau d'un atome comme un corpuscule portant une charge électrique positive.
En fait, le noyau est composé de deux sortes de particules : les protons et les neutrons. Le proton possède une charge positive dont la valeur est égale à la charge négative de l'électron.
Le neutron, comme son nom l'indique, ne porte aucune charge. Les neutrons ne subissent donc aucune force électrique d'attraction ou de répulsion en présence des protons ou des électrons.
La masse du neutron est sensiblement égale à celle du proton; tous deux pèsent environ 1840 fois plus que l'électron. La masse d'un atome est donc surtout concentrée dans son noyau. Le nombre de protons et de neutrons dans le noyau d'un atome dépend de l'élément.
De plus, comme chaque atome est électriquement neutre à l'état normal, il comporte autant de protons que d'électrons.
Le tableau 2-1 donne la composition atomique de quelques éléments. À titre d'exemple, un atome de cuivre contient 29 protons et 35 neutrons dans son noyau, alors que 29 électrons gravitent autour de celui-ci.
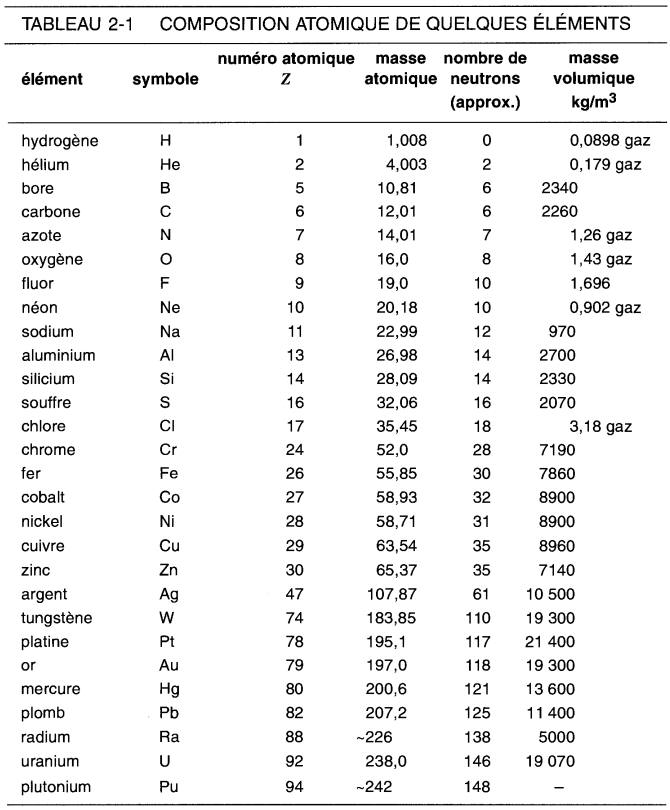
1. Chaque élément possède un nombre défini de protons et d'électrons, donné par le numéro atomique Z. Par contre, dans la nature, le nombre de neutrons sur le noyau d'un élément n'est pas constant.
2. La masse atomique donne la masse relative d'un atome par rapport à un autre, tel que trouvé dans la nature. Ainsi les atomes de cuivre possèdent une masse, qui est, en moyenne, 2,35 plus grande que celle de l'aluminium (63,54/26,98 = 2,35).
3. La masse volumique des gaz correspond à une température de 0 °C et une pression de 101,325 kPa.
Les neutrons font une contribution importante au poids du cuivre, mais aucune en ce qui concerne sa charge électrique.
Toutefois, nous verrons que les neutrons jouent un rôle critique dans les centrales nucléaires.
Résumé
Dans ce chapitre nous avons appris que la matière est constituée d'atomes qui sont regroupés en structures plus complexes appelées molécules.
Les atomes sont constitués d'un noyau contenant des particules positives (les protons) et neutres (les neutrons) autour duquel tournent des particules négatives appelées électrons.
Le nombre de protons est normalement égal au nombre d'électrons si bien que les atomes ou les molécules sont électriquement neutres. Le nombre de protons et d'électrons (numéro atomique) est caractéristique de chaque élément et détermine ses propriétés chimiques.
La presque totalité de la masse de l'atome est concentrée sans le noyau. Comme deux charges de signes contraires s'attirent, les électrons (-) sont attirés par le noyau (+).
Les électrons sont répartis en couches elliptiques autour du noyau. Certains corps appelés conducteurs (ex. : cuivre, aluminium ) peuvent facilement perdre et échanger les électrons de leur couche extérieure.
C'est la mobilité de ces électrons libres qui en se déplaçant d'un atome à l'autre permet la circulation d'un courant électrique. Au contraire, les corps qui peuvent difficilement perdre des électrons sont appelés isolants. Ces matériaux sont utilisés pour empêcher la circulation d'un courant électrique.
Les générateurs ou sources d'électricité ont la propriété de produire une répartition inégale des électrons entre une borne positive (+) ayant un manque d'électrons et une borne négative (-) ayant un surplus d'électrons.
Ces sources utilisent un procédé chimique (ex. : piles), mécanique (ex. : alternateurs), thermique (ex. : thermocouples) ou optique (ex. : cellules photoélectriques).
Lorsque l'on relie un conducteur entre les deux bornes d'une source, un courant se met à circuler dans le conducteur et la source.
Le courant conventionnel (inverse du courant électronique) circule de la borne (+) à la borne (-) dans le conducteur.
PROBLÈMES
2-1 Y a-t-il attraction ou répulsion lorsque deux charges négatives sont rapprochées l'une de l'autre?
2-2 Représenter un atome d'aluminium de façon simplifiée.
2-3 Qu'est-ce qui distingue un conducteur d'un isolant?
2-4 Dans un conducteur métallique, le courant d'électrons se déplace-t-il rapidement?
2-5 Sur quelle couche (intérieure ou extérieure) d'un atome métallique les électrons libres se trouvent-ils?
2-6 Est-ce que les atomes d'un solide sont absolument immobiles?
2-7 Que veut dire «sens conventionnel» d'un courant électrique?
Réponses
10a) 82 protons; 10b) 82 électrons; 10c) 125 neutrons
