Piles et accumulateurs
Les piles sont des sources d'électricité qui transforment directement l'énergie chimique en énergie électrique.
Lorsqu'on raccorde ensemble plusieurs piles pour produire une source de puissance ou de tension supérieure, on obtient une batterie d'accumulateurs que nous désignerons par le seul mot «batterie».
L'invention de la pile électrique, par le professeur italien Alessandro Volta en 1800, constitue une des plus importantes découvertes dans le domaine de l'électricité, car elle permettait d'obtenir, pour la première fois, une source ininterrompue de courant électrique.
Avant cette époque, on ne connaissait que les décharges momentanées produites par l'électricité statique, lesquelles étaient peu propices pour déceler le champ magnétique et les autres phénomènes associés au passage d'un courant.
C'est grâce à ces premières batteries élémentaires de Volta que les découvertes fondamentales d'Oersted, de Faraday et d'autres scientifiques furent rendues possibles.
Principe d'une pile
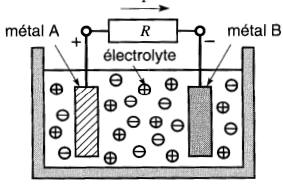
Rien de plus simple que de construire une pile : il suffit de plonger deux conducteurs différents (appelés électrodes) dans une solution d'eau acidulée ou alcaline (appelée électrolyte).
Une force électromotrice (f.é.m.) d'environ 1 volt apparaît alors spontanément entre les deux électrodes. Si l'on branche une résistance entre le pôle positif et le pôle négatif ainsi formés, un courant commence à circuler comme le montre la Fig. 11-1.
Figure 11-1 Deux métaux différents et un électrolyte forment une pile

Le passage du courant produit une transformation graduelle de la composition de l'électrolyte et des deux électrodes et c'est grâce à cette réaction chimique que l'énergie électrique est libérée.
Lorsque l'une des électrodes (ou l'électrolyte) est plus ou moins complètement transformée, la f.é.m. disparaît et le courant cesse de circuler.
La pile est alors épuisée ou déchargée. Dans le cas des piles primaires, la transformation chimique désagrège progressivement l'une des deux électrodes de sorte que la pile n'est plus utilisable lorsqu'elle est déchargée.
Par contre, dans les piles secondaires, ou accumulateurs, la transformation chimique qui s'effectue lors de la décharge est réversible. On peut recharger ces piles en y faisant circuler un courant en sens inverse, ce qui redonne aux électrodes et à l'électrolyte leur composition chimique d'avant la décharge.
Bien que la construction d'une pile soit assez simple, il faut toutefois trouver des électrodes et des électrolytes qui débitent beaucoup d'énergie, qui durent longtemps, qui pèsent peu et ne coûtent pas cher. Les électrochimistes ont réalisé un grand nombre de piles primaires et secondaires dont les plus importantes, du point de vue commercial et industriel, sont données au tableau 11-1.
Les tensions qu'elles développent se situent entre 1,3 et 2 V environ, et leur énergie massique varie de 300 kJ/kg pour une pile sèche au mercure utilisable une seule fois, à 40 kJ/kg pour une pile au plomb rechargeable des centaines de fois.
Théorie de fonctionnement
Les réactions chimiques qui se produisent dans une pile peuvent s'expliquer de la façon suivante (Fig. 11-2).
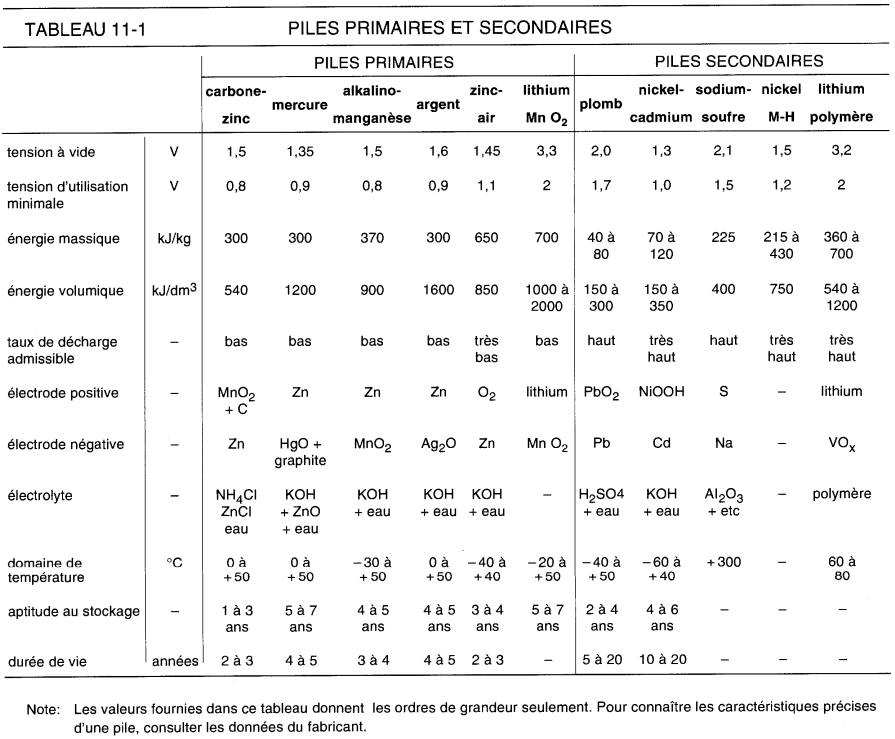
Considérons un électrolyte composé d'un acide mélangé avec de l'eau (Fig. 11-2a).
Figure 11-2a Un acide mélangé avec de l'eau produit un électrolyte qui contient des ions (+) et des ions (-)

L'acide se dissocie en ions positifs et négatifs. Si l'on plonge deux électrodes différentes dans cette solution, on constate que l'une d'elles tend à capter les ions positifs alors que l'autre tend à attirer les ions négatifs. Cette affinité pour l'un ou l'autre des deux types d'ions rend une des électrodes positive et l'autre négative (Fig. 11-2b).
Figure 11-2b L'électrode A a une affinité pour les ions (+), ce qui lui donne une polarité (+). L'électrode B attire les ions (-), ce qui lui donne une polarité (-)
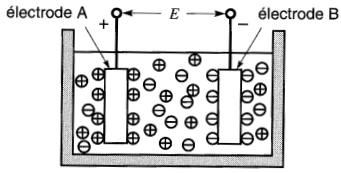
Si l'on raccorde une résistance entre les électrodes, un courant électrique s'établit et les ions positifs de la solution se dirigent vers l'électrode positive tandis que les ions négatifs vont vers l'électrode négative.
Lors du contact avec les deux électrodes, les ions positifs captent des électrons alors que les ions négatifs en perdent; c'est précisément cet échange d'électrons qui provoque la circulation d'un courant électrique.
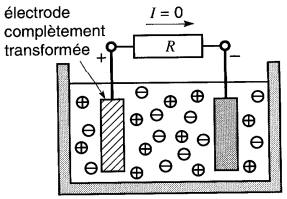
L'acquisition ou la perte d'électrons produit en même temps la transformation chimique des électrodes. Sur la Fig. 11-2c, la partie hachurée des électrodes montre la portion qui a été ainsi transformée.
Figure 11-2c Lorsque les électrodes sont réunies par un élément conducteur R, un courant I se met à circuler
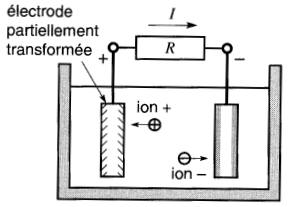
Lorsque l'une des deux plaques est entièrement transformée (Fig. 11-2d), le courant cesse de circuler. Malgré leurs caractéristiques particulières, les piles ont plusieurs propriétés en commun.
Figure 11-2d La circulation du courant transforme les deux électrodes
Nous étudierons d'abord ces caractéristiques semblables et analyserons ensuite les propriétés spéciales qui distinguent les piles présentées au tableau 11-1.
Résistance interne
Au moment où l'on raccorde une résistance extérieure aux bornes d'une pile, on constate que la différence de potentiel diminue. Ce résultat provient du fait que la pile possède une résistance interne provoquant une chute de tension à l'intérieur de la pile.
On peut donc représenter une pile par une source de tension E° en série avec une résistance r (Fig. 11-3).
Figure 11-3 Pile sèche et son circuit équivalent
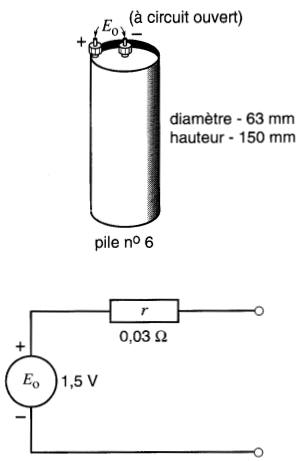
La résistance interne dépend de la capacité de la pile, de son état de décharge, de son âge, de sa température et de sa constitution chimique.
Par exemple, la résistance interne d'une pile primaire neuve N° 6 au carbone-zinc (diamètre 63 mm, hauteur 150 mm) est de 0,03Ω environ.
Cette résistance n'est pas constante; elle augmente lorsque la pile vieillit et au fur et à mesure qu'elle se décharge. Cependant, pour des courants normaux, la chute de tension interne est de l'ordre de 10 % de la tension à vide.
Exemple 11-1
Une pile a une f.é.m. de 1,5 V et une résistance interne de 0,2Ω.
Calculer l'intensité du courant et la tension entre les bornes A et B de la pile lorsqu'on la raccorde à une résistance de 1Ω (Fig. 11-4a).
Figure 11-4a Charge raccordée aux bornes d'une pile (exemple 11-1)
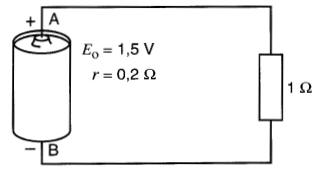
Solution
La résistance interne r agit en série avec la f.é.m. (Fig. 11-4b).
Figure 11-4b Calcul du courant et de la tension utilisant le circuit équivalent d'une pile (exemple 11-1)
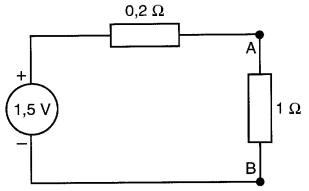
La résistance totale du circuit vaut:
R = 1,0 + 0,2 = 1,2Ω
L'intensité du courant est alors
I = 1,5 V / 1,2Ω= 1,25 A
La chute de tension interne est:
e = rI = 1,25 X 0,2 = 0,25 V
La tension entre les bornes A et B vaut alors
EAB = (1,5. 0,25) = 1,25 V
Décharge d'une pile Lorsqu'une pile alimente une charge, la tension à ses bornes diminue très lentement pendant la décharge puis tombe brusquement seulement lorsque la pile est presque épuisée (Fig. 11-5).
Figure 11-5 Courbes de décharge d'une pile au carbone-zinc (a) et d'une pile au mercure (b)
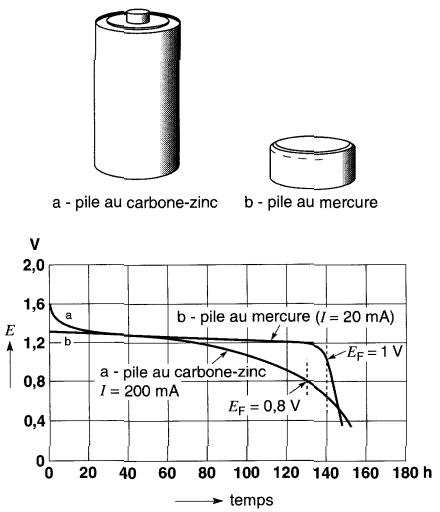
Lorsque la tension atteint la valeur ultime EF, habituellement spécifiée par le fabricant, on considère que la pile est déchargée. Dans le cas d'une pile primaire, on peut se permettre de l'épuiser davantage, sachant que, de toute façon, on doit la jeter.
Mais pour une pile secondaire, il faut se garder de trop la décharger, car cela peut réduire son pouvoir de récupération lorsqu'on veut la recharger.
Capacité d'une pile
La capacité d'une pile est la quantité d'électricité qu'elle peut débiter avant que la tension à ses bornes atteigne la tension EF de la Fig. 11-5.
Cette capacité s'exprime généralement en ampères-heures (A.h), bien qu'on puisse la donner en coulombs (1A.h = 3600 C).
Une pile sèche ayant une capacité de 30 A.h peut donc débiter un courant de 1 A pendant 30 heures, ou bien 1/10 d'ampère pendant 300 heures.
Cependant, la pile ne pourra pas débiter un courant de 10A pendant 3 heures (même si le produit 3A x 10h donne 30 A.h), car la polarisation de la pile serait excessive et la tension aux bornes tomberait brusquement.
La capacité d'une pile n'est donc pas constante, mais dépend de l'intensité du courant débité. Plus le courant est intense, plus sa capacité en ampères-heures diminue.
Ordinairement, la capacité est spécifiée pour un temps de décharge de 8 heures. Parfois on spécifie des périodes de 5 heures, ou de 1 heure.
On doit alors se rappeler que si le temps de décharge est plus court que celui spécifié par le fabricant, on perd de la capacité et que, dans le cas contraire, on en gagne.
Couplage des piles
L' énergie limitée et la tension peu élevée des piles nécessitent leur couplage. On obtient alors une batterie électrique.
1. Groupement en série.
Dans un groupement en série, les piles sont placées les unes à la suite des autres, la borne (+) de chaque pile étant relié à la borne (-) de la pile suivante (Fig. 11-6). Les deux bornes libres constituent les bornes de la batterie.
Figure 11-6 Groupement de deux piles en série alimentant une charge R Le «boîtier» des piles est négatif; le pôle noir est positif

La force électromotrice de la batterie de piles groupées en série est égale à la somme des forces électromotrices de chaque pile.
La résistance interne de la batterie est égale à la somme des résistances internes de chaque pile. La batterie d'une lampe de poche est généralement formée de deux ou trois piles groupées en série.
Exemple 11-2
Trois piles sèches ayant chacune une résistance interne de 0.3Ω et une f.é.m. de 1.5V sont groupées en série.
Quelle sera l'intensité du courant si l'on relie une résistance de 10Ω aux bornes de cette batterie?
Solution
La force électromotrice de la batterie est:
E = 3 x 1,5V = 4,5V
La résistance interne de la batterie est:
r = 3 X 0,3Ω = 0,9Ω
La résistance totale du circuit vaut donc:
R = 0,9 + 10,0 = 10,9Ω
Le courant dans le circuit est:
I = 4,5V / 10,9Ω = 0,413A
La tension aux bornes de la résistance extérieure (et aux bornes de la batterie) vaut donc :
E12 = 10Ω x 0,413A = 4,13V
2. Groupement en parallèle.
Quand un appareil requiert une intensité de courant plus grande que celle qu'une pile peut normalement lui fournir, on est amené à grouper les piles semblables en parallèle.
Dans ce montage, les bornes (+) sont reliées ensemble et les bornes (-) sont reliées ensemble (Fig. 11-7). La f.é.m. de la batterie composée de piles semblables est la même que celle d'une seule pile.
Figure 11-7 Groupement de deux piles en parallèle
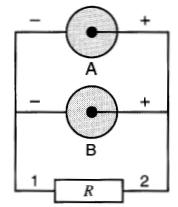
Si les résistances internes des piles sont égales, le courant débité par chacune d'elles est égal au courant total divisé par le nombre de piles.
Si la résistance interne de l'une des piles est plus élevée que celle des autres, elle débite un courant moins élevé que celui débité par chacune des autres piles.
Toutes les piles que l'on veut grouper en parallèle doivent être du même type. Il est très important de relier les bornes de même signe ensemble.
En effet, si la polarité de l'une des piles est inversée dans la batterie, cette pile sera détruite en quelques minutes. De plus, les autres piles se déchargeront complètement.
3. Groupement mixte.
Quand on désire obtenir une tension et un courant plus élevés que ceux d'une seule pile, on emploie le groupement mixte (ou série-parallèle).
Ainsi, à la Fig. 11-8, le groupement mixte est formé de deux groupes de deux piles en série, ces deux groupes étant eux-mêmes reliés en parallèle.
Figure 11-8 Groupement de quatre piles en série-parallèle
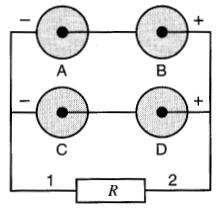
Exemple 11-3
On désire alimenter sous une tension de 6V un relais dont la bobine a une résistance de 40Ω. On dispose de piles sèches de 1,5V avant une capacité de 30 A.h.
Combien de piles sont requises et comment doit-on les grouper pour assurer l'alimentation du relais pendant un minimum de 375 heures?
Solution
Tout d'abord, pour fournir la tension de 6V, il suffit de raccorder 4 piles en série. Le courant tiré par le relais est
I = 6V/40Ω = 0,15A
Chaque pile pourrait facilement débiter ce courant, sans que sa capacité en ampères-heures soit diminuée.
Il serait donc possible de relier seulement 4 piles en série pour alimenter le relais. Cependant, avec ce groupement, chaque pile de la batterie serait épuisée au bout de 200 heures, car 30 A.h/0,15A = 200 h.
Il faudra donc limiter le courant débité par les piles à un maximum de 30 A.h/375 h = 0,08A.
Comme le courant requis est de 0,15A, il suffit de mettre en parallèle 0,15 A/0,08 A = 1,87 groupes de 4 piles en série pour alimenter le relais. Comme il est impossible de réaliser des groupes fractionnaires, on doit utiliser deux groupes en parallèle.
Ce groupement mixte de 8 piles est montré à la Fig. 11-9. Dans ce montage, chaque pile débitera un courant de 0,15 A/2 = 0,075A.
Figure 11-9 Voir exemple 11-3
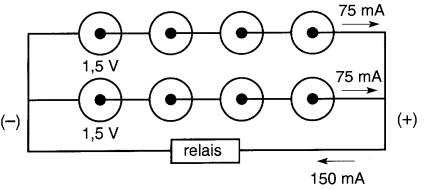
PILES PRIMAIRES
La plupart des piles primaires sont des piles sèches. On désigne sous ce nom les piles dont l'électrolyte est immobilisé par une substance absorbante. Puisqu'elles sont scellées, on peut les transporter et les orienter dans tous les sens sans risquer de répandre l'électrolyte.
Polarisation
Lors de la décharge d'une pile dans un circuit extérieur, il arrive souvent que de l'hydrogène se dégage sur une des électrodes et entoure celle-ci de bulles de gaz. Comme ces bulles d'hydrogène sont de très mauvais conducteurs d'électricité, elles empêchent le passage du courant.
On constate alors que le courant diminue d'autant plus rapidement que la pile est soumise à un taux de décharge plus élevé. Ce phénomène s'appelle la polarisation.
Pour éviter la polarisation de la pile, on utilise une substance, appelée dépolarisant, qui absorbe l'hydrogène au fur et à mesure de sa formation.
Pile au carbone-zinc
La pile au carbone-zinc, très répandue comme pile pour les lampes de poche, comporte un récipient en zinc qui constitue le pôle négatif (Fig. 11-10).
Figure 11-10 Vue en coupe d'une pile «Eveready» au carbone-zinc
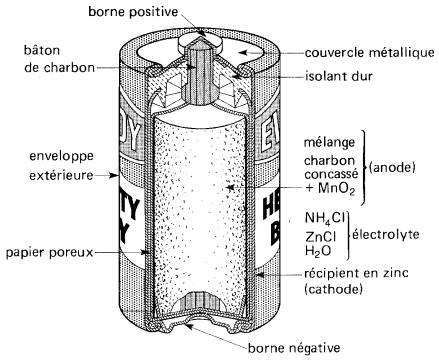
Le pôle positif est un mélange de charbon concassé et de bioxyde de manganèse; l'électrolyte est un mélange de chlorure d'ammonium et de chlorure de zinc dissous dans l'eau. Ce mélange entoure un bâton de charbon qui sert de conducteur pour amener le courant à l'extérieur.
Le récipient de zinc est séparé du mélange par une couche de papier poreux. Lors de la décharge, la réaction chimique consomme le zinc, à un taux d'environ un gramme par ampère-heure. Cette pile contient une énergie d'environ 540 J/cm3.
Pile au mercure
La pile primaire au mercure (Fig. 11-11) possède plusieurs avantages.
Figure 11-11 Vue en coupe d'une pile au mercure
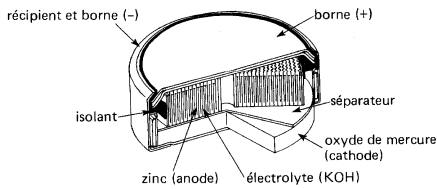
Elle est robuste, petite, et peut être entreposée pendant de longues périodes. Sa résistance interne est basse de sorte que sa tension demeure très constante lors de la décharge. Sa tension, à circuit ouvert, demeure tellement stable qu'on peut l'utiliser comme source de tension de référence.
Elle contient trois fois plus d'énergie par unité de volume que la pile au carbone-zinc, ce qui explique son emploi dans les postes de radio portatifs, les missiles, les instruments de mesure portatifs, les montres électroniques, les prothèses auditives et dans les appareils pour stimuler le coeur.
Lorsque vous identifiez le type de pile bouton que vous possédez, assurez-vous de faire la différence entre les piles à oxyde d'argent et les piles au lithium ou alcalines.
Ces piles sont identifiées par un code alphanumérique. En général, les premières lettres du code alphanumérique identifient le type de pile.
Les premières lettres (LR) indiquent une pile alcaline et peuvent être jetées à la poubelle.
Les piles avec les premières lettres (CR) indiquent une pile au lithium, (SR) indique une pile à oxyde d'argent qui contient des métaux lourds. Les piles identifiées par une lettre (P) sont rechargeables et contiennent des métaux lourds et/ou du mercure.
Pile aikalino-manganèse
Comme les piles au mercure, ces piles primaires alkalino-manganèse (Fig. 11-12) peuvent être entreposées pendant de longues périodes sans se détériorer sensiblement.
Figure 11-12 Vue en coupe d'une pile alkalino-manganèse
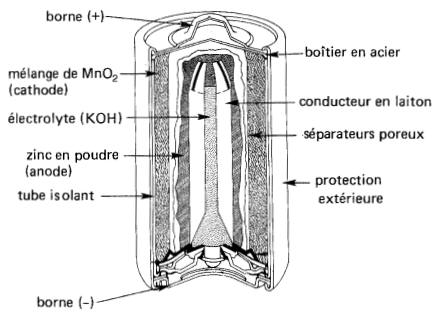
Bien que leur résistance interne ne soit pas aussi basse, et leur tension pas aussi stable, elles emmagasinent environ 900 J/cm3. Elles sont supérieures aux piles carbone-zinc lorsqu'il faut alimenter des petits moteurs, des appareils photographiques, etc., qui demandent un gros débit de courant pendant une courte période.
Durée de vie d'une pile primaire
À cause de réactions chimiques secondaires, une pile se détériore même si elle n'est pas utilisée.
Ainsi, la capacité d'une pile neuve au carbone-zinc gardée dans une pièce à une température normale (20 °C) devient à peu près nulle au bout de 4 ans. La température a une influence sur la durée d'une pile : une température élevée accélère les réactions chimiques secondaires et diminue sensiblement sa vie utile.
PILES SECONDAIRES
Les deux principaux types de piles secondaires sont les piles au plomb et les piles au nickel-cadmium (Ni-Cd). Elles sont utilisées pour fournir des puissances importantes pendant les pannes d'électricité sur un réseau ou, encore, pour alimenter les dispositifs qu'on ne peut pas raccorder facilement à un réseau de distribution électrique.
Ces deux applications principales permettent de distinguer deux types de piles:
celles qui travaillent peu souvent, mais qui doivent être toujours disponibles (éclairage d'urgence dans les édifices, source d'énergie auxiliaire dans les postes électriques)
et celles qui sont utilisées dans les appareils mobiles (automobiles, voitures électriques, sous-marins, avions, etc.).
La première application exige une pile extrêmement fiable qui dure de 15 à 25 ans, tandis que la seconde demande une pile possédant beaucoup d'énergie par rapport à sa grosseur, même si sa durée de vie est quelque peu restreinte.
À cause de son coût peu élevé, la pile au plomb est la plus répandue, mais la pile au Ni-Cd trouve des applications lorsqu'on doit fournir de grandes puissances pendant de courtes périodes ou lorsque l'entretien périodique par un personnel qualifié est impossible.
Rendement d'une pile secondaire
Lorsqu'on recharge une pile secondaire, la quantité d'électricité, en coulombs, qu'elle reçoit est presque entièrement récupérable lors de la décharge. Selon son état et sa construction, on peut obtenir des rendements ampériques de l'ordre de 80 % à 90 %.
Donc, une batterie qui reçoit 100 A.h d'électricité pendant la charge peut débiter de 80 à 90 A.h lors de la décharge.
Par ailleurs, le rendement énergétique se situe entre 50 % et 70 % seulement, car la tension lors de la charge est sensiblement supérieure à celle qui existe lors de la décharge.
On définit le rendement énergétique comme étant le rapport entre l'énergie en joules récupérée lors de la décharge et l'énergie fournie durant la charge.
Production d'hydrogène
Plusieurs piles secondaires contiennent de l'eau dont les molécules sont constituées de deux atomes d'hydrogène et d'un atome d'oxygène.
Quand on recharge une batterie et surtout si l'on dépasse le seuil normal de charge, l'eau se transforme peu à peu en hydrogène et en oxygène. On peut observer le dégagement de ces gaz à l'extérieur par le bouillonnement de l'électrolyte.
Dans les piles secondaires scellées, ce dégagement des gaz peut produire une pression interne de 400 kPa (relative) avant de provoquer l'ouverture d'une soupape de sécurité.
Pour les piles ouvertes, l'hydrogène forme avec l'air un mélange explosif. On doit donc éviter que le volume d'hydrogène à un endroit ne dépasse 3 % du volume d'air.
La quantité d'hydrogène libérée par une batterie déjà complètement chargée est donnée par l'expression approximative:
V = 0,25 EIt
où
V = volume
d'hydrogène, en litres [L]
E = tension de la batterie, en volts [V]
I = courant, en ampères [A]
t = durée de la surcharge, en heures [h]
Par exemple, si l'on fait passer un courant de surcharge de 2A dans une batterie d'automobile de 12V, elle dégage, dans une journée, environ:
V = 0,25 Elt = 0,25 x 12V x 2A x 24 h = 144 L d'hydrogène
On doit donc bien ventiler une pièce contenant des batteries en charge et éviter d'y fumer.
De plus, comme chaque mètre cube (1000 litres) d'hydrogène est produit par l'électrolyse de 0,8 litre d'eau, il faut ajouter de l'eau périodiquement à la batterie.
Enfin, mentionnons comme autre mesure de sécurité que les électrolytes des piles secondaires sont très corrosifs et que l'on doit éviter tout contact avec les yeux.
Pile au plomb. théorie de fonctionnement
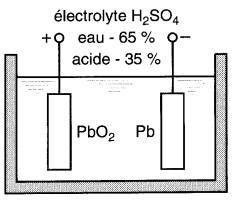
Une pile au plomb élémentaire est constituée d'une plaque de plomb spongieux (Pb), et d'une plaque de bioxyde de plomb (PbO2) plongées dans une solution d'acide sulfurique (H2SO4).
La Fig. 11-13a représente schématiquement les plaques d'une pile qui vient d'être chargée. Les réactions chimiques qui se produisent sont généralement expliquées par la théorie suivante.
Figure 11-13a Pile au plomb chargée
1. Décharge
Lorsque les bornes de la pile sont reliées à une charge extérieure, les réactions chimiques font circuler un courant (Fig. 11-13b).
Figure 11-13b Pile au plomb lors de la décharge
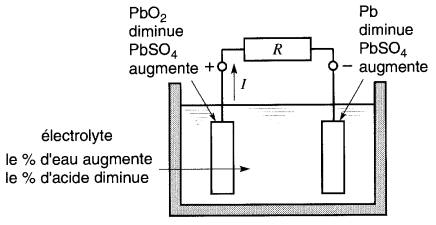
Pendant cette décharge, le bioxyde de plomb de la plaque positive se transforme graduellement en sulfate de plomb (PbSO4) et le plomb spongieux de la plaque négative se transforme également en sulfate de plomb.
Lorsque les plaques deviennent à peu près identiques, la tension entre celles-ci devient nulle et le courant cesse (Fig. 11-13c).
Figure 11-13c Pile au plomb déchargée
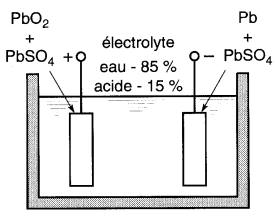
2. Charge
On peut recharger la pile en la reliant aux bornes d'une source à courant continu, de la façon indiquée à la Fig. 11-13d.
Figure 11-13d Pile au plomb en charge
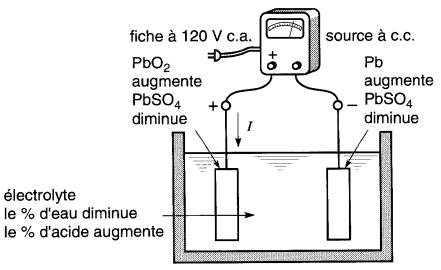
La borne (+) de la source est relié à la borne (+) de l'accumulateur. On remarquera, en comparant les Fig. 11-13b et 11-13d, que le sens du courant pendant la charge est l'inverse de celui du courant de décharge.
Le sulfate de plomb est dissous par le passage du courant et les plaques reprennent leur état initial, comme le montre la Fig. 11-13a.
Caractéristiques d'une pile au plomb
La tension aux bornes d'une pile au plomb pendant les périodes de charge et de décharge normales est donnée à la Fig. 11-14.
Figure 11-14 Variation de la tension et de la densité de l'électrolyte pour une pile au plomb, lors de la décharge et de la charge
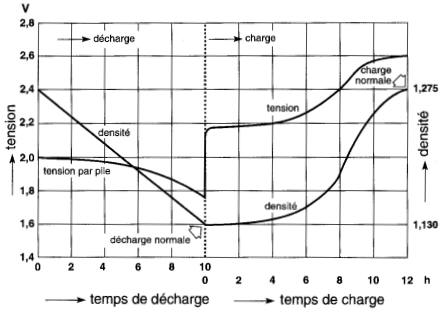
Le courant nominal est généralement basé sur une durée de décharge de 8 heures.
Ainsi, un accumulateur de 160 A.h a un courant nominal de 160. 8 = 20A.
La résistance interne d'une pile utilisée dans une batterie d'automobile est seulement de l'ordre de 2 mΩ
Une telle batterie de 12 V, constituée de six piles de 2V groupées en série, peut avoir à fournir un courant de l'ordre de 200 à 400A pendant l'intervalle très court requis pour le démarrage du moteur.
Le tableau 11-1 indique que l'énergie massique peut être de 40 kJ/kg ou de 80 kJ/kg selon l'application de la pile.
Cette différence importante provient du fait que l'électrolyte des sources d'urgence est maintenue à une densité relative de 1,21 comparativement à 1,28 pour une batterie d'automobile.
En effet, une densité plus faible impose des électrodes plus grosses, ce qui assure en même temps une durée de vie plus longue.
Entretien d'une batterie
L'entretien d'une batterie est souvent dicté par l'usage qu'on en fait.
Ainsi, une batterie d'automobile reçoit un soin plus ou moins attentif, tandis qu'une batterie de centrale hydro-électrique exige une surveillance suivie et systématique. La durée de vie moyenne de la première est de 5 ans, et celle de la seconde, de 20 ans (Fig. 11-15).
Figure 11-15 Batterie au plomb ayant une durée de vie de 15 ans et plus

On doit vérifier fréquemment le niveau de l'électrolyte et le maintenir à une position déterminée par l'addition d'eau distillée.
La densité de la solution d'acide sulfurique donne une indication de la condition de charge de la batterie. L' eau pure a une densité relative de 1,00 alors que celle de l'acide sulfurique pur est de 1,85.
La solution acide d'une batterie d'automobile qui vient d'être chargée a une densité d'environ 1,28 tandis que celle d'une batterie complètement déchargée est de 1,12.
La détermination de la densité se fait au moyen d'un pèse-acide (Fig. 11-16). Le pèse-acide est plongé dans l'électrolyte et le point d'affleurement du liquide sur la graduation donne la densité.
Figure 11-16 Mesure de la densité de l'électrolyte au moyen d'un pèse-acide

On ne doit jamais abandonner une batterie qui est partiellement déchargée, car un repos prolongé provoque la sulfatation des plaques. Le dépôt blanchâtre de sulfate de plomb sur les plaques devient dur et insoluble dans l'acide; la surface active des plaques est réduite et leur résistance interne augmente. La capacité de la batterie est ainsi réduite.
Si la sulfatation est légère, on peut la faire disparaître en faisant subir à la batterie une longue surcharge à faible intensité de courant.
On ne doit jamais pousser la décharge au-dessous de 1,6V, car le dépôt de sulfate sur les plaques devient alors très dur et très résistant; ce sulfate durci étant insoluble, les plaques sont endommagées de façon permanente. Il est nécessaire de prendre quelques précautions pendant la charge de la batterie.
Ainsi, on ne doit pas pousser la charge trop loin, car le dégagement gazeux abondant désagrège les plaques. Lorsqu'on désire accélérer la réaction en amorçant la charge avec un courant initial intense, l'intensité de celui-ci ne doit pas dépasser le nombre exprimant la capacité en ampères-heures.
Par exemple, le courant initial ne doit pas dépasser 160A pour une batterie ayant une capacité de 160 A.h. L'intensité de ce courant doit être diminuée à mesure que la batterie se charge.
Les accumulateurs au plomb doivent être protégés contre le gel, car même s'ils peuvent supporter des températures aussi basses que.40 °C lorsqu'ils viennent d'être chargés, leur résistance au froid est beaucoup moins bonne lorsqu'ils sont partiellement déchargés.
Il faut donc tenir les accumulateurs bien chargés en hiver, car autrement l'eau gèle, ce qui fend le boîtier. La Fig. 11-17 montre la vue en coupe d'une batterie d'automobile.
Figure 11-17 Vue en coupe d'une batterie d'automobile de 12V
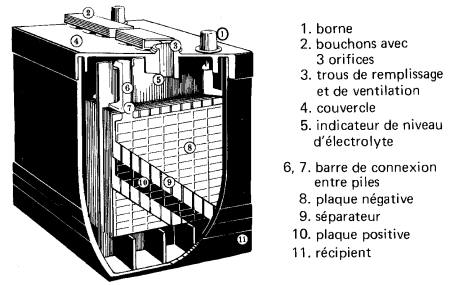
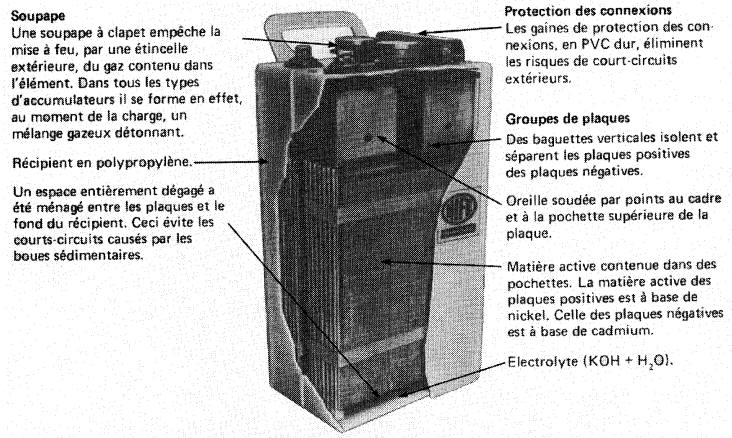
ile au nickel-cadmium La pile au nickel-cadmium (Fig. 11-18) est constituée d'une électrode positive en hydroxyde de nickel et d'une électrode négative en cadmium, plongées dans une solution alcaline d'hydroxyde de potasse (KOH). Pour les applications stationnaires, l'énergie volumique est comparable à celle des piles au plomb.
Figure 11-18 Vue en coupe d'une pile au nickel-cadmium
Les principaux avantages de la pile au Ni-Cd sont les suivants:
elle peut débiter des puissances énormes pendant de courtes périodes, on peut la décharger complètement sans nuire à ses caractéristiques, elle se décharge très lentement pendant les périodes inactives, elle ne dégage pas de vapeurs nocives d'acide sulfurique et elle est facile à entretenir.
Son débit élevé pendant de courtes périodes explique pourquoi on l'utilise pour le démarrage des moteurs à explosion. De plus, puisqu'on peut la charger et décharger des milliers de fois, elle trouve une application importante dans les installations stationnaires (Fig. 11-19).
Figure 11-19 Batterie composée de 3 groupes de 328 piles au nickel-cadmium, installée à l'aéroport de Sturup à Malmô, Suède.

En cas de panne du réseau principal, elle assure la continuité du service jusqu'à la mise en marche des génératrices d'urgence. Cette batterie alimente un onduleur électronique de 180 kVA qui transforme le courant continu en courant alternatif.
La densité de l'électrolyte, formée d'une solution de 20 % de KOH et de 80 % d'eau, ne change pas pendant la charge et la décharge. On ne peut donc pas mesurer l'état de la pile au moyen d'un pèse-acide.
Cependant, comme pour la pile au plomb, l'eau se décompose lorsqu'on dépasse le seuil normal de charge, libérant de l'hydrogène et de l'oxygène.
Piles primaires et secondaires spéciales
Il existe un grand nombre de piles primaires et secondaires spéciales qui, ont été développées pour diverses applications.
Par exemple, la pile primaire au lithium/ dioxide de manganèse est utilisée dans certains dispositifs électroniques qui requièrent la conservation, à long terme, de données en mémoire, ou pour enregistrer la date.
Une autre pile primaire au lithium-ion sert à alimenter les pacemakers sur une période de cinq à dix ans. Cette pile d'une grande fiabilité fournit quelques microampères seulement.
On développe présentement des piles secondaires spéciales pouvant fournir les grandes énergies et puissances requises pour alimenter les voitures électriques.
Parmi les candidats possibles, mentionnons les piles au sodium-soufre et au disulfure de fer et de lithium. Toutes deux fonctionnent à haute température. Les propriétés de la pile au sodium-soufre sont résumées dans le tableau 11-1.
Dernièrement, on a eu recours à une autre batterie secondaire à base de lithium/métal-hydraté pour la traction automobile.
En 1997, une voiture électrique, équipée de batteries de ce type, a effectué le trajet Boston-New York, une distance de 340 km, sans recharge. On a utilisé 180 piles, donnant une tension de fonctionnement de 220V, une capacité totale de 126 A.h, et un poids de 431 kg.
L'énergie dépensée pour franchir la distance à une vitesse approximative de 85 km/h a été de 27,8 kW.h.
D'autres batteries, à base de lithium-polymère, sont présentement à l'étude pour alimenter les voitures électriques. Ce type d'accumulateur, baptisé ACEP (accumulateur à électrolyte polymère) a été développé par un groupe de chercheurs d'Hydro-Québec, de pair avec des sociétés américaines.
La société 3M et le United States Advanced Battery Consortium, un partenariat associant General Motors, Ford, Chrysler et l'Electric Power Research Institute, avec la participation du Département d'état américain de l'Énergie (DOE) et le Argonne International Laboratory.
L'accumulateur est composé de cinq feuilles très minces enroulées ensemble sous forme de rectangle, comme le montre la Fig. 11-20.
Figure 11-20 Construction d'une cellule ACEP
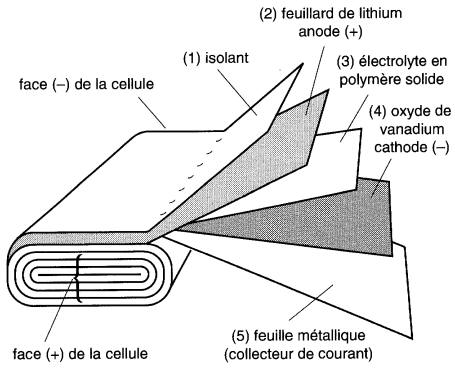
La première feuille est un isolant, la deuxième est un feuillard de lithium métallique qui constitue l'anode (+).
La troisième feuille est l'électrolyte à polymère solide, suivie par une feuille polymère à base d'oxyde de vanadium qui devient la cathode (-).
Enfin, la cinquième feuille agit comme collecteur métallique du courant. Les cinq feuilles ont une épaisseur totale de 0,1 mm seulement. En régime normal, la tension est maintenue entre 3,2V et 2,0V.
Le tableau 11-2 donne les caractéristiques d'un module composé de 8 cellules.
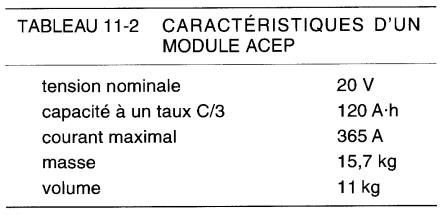
Le taux C/3 correspond à une décharge de 3 heures à courant constant. Comme la capacité est de 120 A.h, le courant correspondant est de 40A. La batterie peut être chargée et rechargée plusieurs centaines de fois. Afin d'assurer une bonne performance elle est maintenue à une température entre 60 °C et 80 °C.
De plus, la tension de chaque cellule est surveillée et régularisée par un microprocesseur. La batterie ACEP offre une capacité énergétique par unité de masse neuf fois supérieure à celle d'une batterie au plomb conventionnelle. Comme il n'y a pas d'électrolyte liquide, elle peut être orientée dans toutes les directions.
Enfin, comme ses plaques sont très minces et souples, on peut donner à la batterie n'importe quelle forme géométrique, ce qui permet de l'adapter à de nombreux usages. Cette batterie, encore en développement, indique le grand intérêt que l'on porte à la voiture électrique du futur.
PILES À COMBUSTIBLE
Lorsqu'on fait brûler du bois, du charbon ou du gaz naturel, l'oxygène de l'atmosphère réagit avec le combustible pour produire une nouvelle substance.
Cette réaction chimique s'appelle oxydation. L'oxydation d'un combustible dégage de grandes quantités d'énergie, principalement sous forme de chaleur. La chaleur dégagée peut être utilisée pour produire de la vapeur qui fait tourner une turbine. Cette turbine entraîne à son tour une génératrice qui produit de l'électricité.
Malheureusement, lorsqu'on utilise de la chaleur pour produire de l'électricité, le rendement est très faible.
Par exemple, le rendement d'un système thermoélectrique pouvant débiter une puissance de 1 kW est à peine de 20 %.
Pour les grosses installations de 1000 MW, le rendement est seulement de l'ordre de 40 %. De plus, ces rendements sont obtenus en utilisant des températures à la limite de ce que les métaux peuvent supporter.
Dans une pile à combustible, on contourne le problème du faible rendement et des hautes températures en combinant l'oxygène avec le combustible d'une manière très astucieuse. En effet, la pile à combustible est un dispositif qui permet l'oxydation d'un combustible sans le brûler.
La quantité d'énergie libérée est la même, mais elle apparaît directement sous forme d'énergie électrique. Comment peut-on réaliser cette transformation?
Une pile à combustible est constituée essentiellement de deux électrodes A et B en contact avec un électrolyte (Fig. 11-21). Elle comprend aussi un combustible et une source d'oxygène.
Figure 11-21 Composants fondamentaux d'une pile à combustible
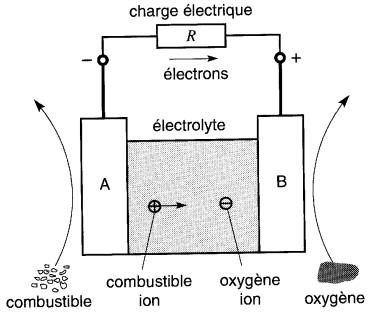
Le combustible que l'on désire oxyder est mis en contact avec l'électrode A, tandis que de l'oxygène est mis en contact avec l'électrode B. La charge électrique est raccordée entre les deux électrodes.
Lorsque le combustible vient en contact avec son électrode il se produit une réaction spéciale qui a pour effet de décomposer le combustible en ions positifs et en électrons. Ces ions sont absorbés par l'électrolyte, où ils se déplacent lentement vers l'électrode B.
Les électrons, par contre, sont captés par l'électrode A, traversent la charge et continuent vers l'électrode B. Les molécules d'oxygène qui touchent l'électrode B viennent capter ces électrons. Il s'ensuit que ces molécules deviennent des ions négatifs qui se répandent dans l'électrolyte.
L'électrolyte contient donc des ions positifs venant de l'électrode A et des ions négatifs venant de l'électrode B. Les ions positifs et négatifs se combinent pour former une substance électriquement neutre. Cette substance s'accumule avec le temps et doit être enlevée afin d'empêcher la contamination de la pile.
L'oxydation se produit donc à l'intérieur de l'électrolyte où les ions négatifs d'oxygène et les ions positifs du combustible se réunissent.
Cependant, comme aucune énergie n'entre en jeu lors de cette réaction, toute l'énergie issue de l'oxydation est libérée aux électrodes sous forme d'énergie électrique. Les électrons libérés à l'électrode A sont captés à l'électrode B de sorte qu'un courant continu circule dans la charge. L'électrode en contact avec le combustible est toujours négative.
Selon le combustible utilisé, la différence de potentiel entre les deux électrodes varie entre 0,5V et 3V.
En théorie, la puissance électrique fournie à la charge est égale à la puissance thermique qui serait libérée si on brûlait le combustible. En pratique, il y a des pertes mais le rendement, même pour les petites piles à combustible, atteint 40 %.
Cette utilisation directe de la combustion pour produire de l'électricité constitue donc une nette amélioration par rapport à la méthode conventionnelle utilisant les transformations intermédiaires en énergie thermique et mécanique.
La pile à hydrogène-oxygène
Les piles à combustible sont très complexes; par conséquent, nous nous limiterons à une description sommaire de la pile à combustible la plus simple: la pile à hydrogène-oxygène.
Il est bien connu que la combustion de 1 kg d'hydrogène consomme 8 kg d'oxygène. La réaction dégage 120 MJ de chaleur et le produit résultant est simplement 9 kg d'eau.
Lorsque l'hydrogène est employé dans une pile à combustible, les électrodes sont faites en platine et l'électrolyte est une solution d'acide sulfurique.
De l'hydrogène est continuellement fourni à l'électrode A et de l'oxygène à l'électrode B (Fig. 11-22).
Figure 11-22 Modèle simplifié d'une pile à combustible à hydrogène-oxygène
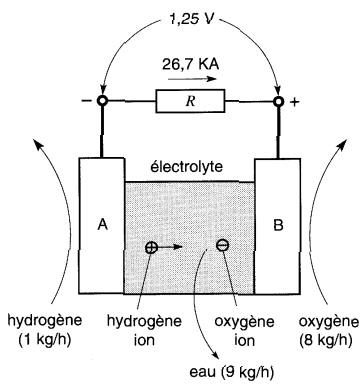
Si on fournit 1 kg d'hydrogène et 8 kg d'oxygène par heure aux électrodes respectives, la réaction chimique produit 120 MJ/heure, soit une puissance électrique de 33,3 kW.
La tension théorique est de 1,25V; il en résulte un courant débité de 33,3 kW =1,25V = 26,7 kA. On remarque que, tout comme les piles conventionnelles, les piles à combustible sont des dispositifs à fort courant et faible tension.
Types de piles à combustibles
Il existe plusieurs façons de construire une pile à combustible.
Le combustible peut être un solide, un liquide ou un gaz, et l'électrolyte peut être un solide ou un liquide.
De plus, l'oxygène peut être utilisé à l'état pur ou combiné avec d'autres substances. La température de fonctionnement dépend du design ; certaines piles fonctionnent à des températures de 60 °C, d'autres donnent leur meilleure performance à 1000°C.
Figure 11-23

Cette pile à combustible contient 456 cellules raccordées en série. Vingt de ces unités modulaires sont connectées en série-parallèle pour fournir une puissance de 4500 kW.
Détails de construction:
électrolyte; acide phosphorique; température de fonctionnement: 190 °C;
tension par cellule : environ 0,7V densité de courant par cellule: 2500 A/m²; rendement énergétique : 9500 Btu/kW.h; temps de démarrage à partir de 21 °C: 4h; temps de réponse: 0,5 s de 35 % à 100 % de la puissance nominale.
Une pile à combustible est donc essentiellement une pile primaire dans laquelle les agents électrochimiques sont fournis constamment à une enceinte appropriée et dont les produits résiduels sont constamment évacués.
Une telle pile ne se décharge jamais car les produits actifs (combustible et oxygène) sont remplacés au fur et à mesure qu'ils sont consommés.
En résumé, la pile à combustible est un convertisseur d'énergie chimique-électrique exceptionnel car :
1. elle donne un rendement élevé par rapport à un système thermoélectrique ;
2. elle peut être construite de façon modulaire et des unités peuvent être ajoutées selon le besoin ;
3. elle ne fait aucun bruit et elle ne produit pour ainsi dire pas de pollution. La Fig. 11-23 montre une pile à combustible ayant une puissance nominale de 240 kW.
Résumé
Les piles permettent d'emmagasiner de l'électricité sous forme chimique. Elles sont constituées essentiellement de deux électrodes, une électrode positive (+) et une électrode négative (-) en contact avec un électrolyte solide ou liquide.
Lorsque la pile débite un courant, la circulation des ions (+) et des électrons à travers l'électrolyte produit une transformation graduelle des électrodes. Il existe une grande variété de piles utilisant différents types d'électrolytes et d'électrodes.
On peut toutefois les regrouper en deux grandes catégories : les piles primaires qui ne sont plus utilisables une fois déchargées et les piles secondaires que l'on peut recharger des centaines de fois.
Selon le type de pile la tension développée à vide est comprise entre 1,3V et 3V environ. Toutefois, toute pile possède une résistance interne réduisant sous charge la tension disponible entre ses bornes.
Pour obtenir une tension ou un courant plus élevé on raccorde les piles en série et en parallèle pour former une batterie ou accumulateur. La quantité de charge qu'une batterie peut fournir est exprimée en ampères-heures.
La densité d'énergie ou énergie massique emmagasinée peut varier de 40 kJ/kg pour une batterie au plomb à 700 kJ/kg pour les piles au lithium.
Les piles primaires les plus courantes sont la pile au carbone-zinc, la pile au mercure, la pile alkalino-manganèse. Les deux principaux types de pile secondaire sont la pile au plomb et la pile au nickel-cadmium.
Des développements récents de piles secondaires spéciales à forte énergie massique permettent d'envisager le développement de la voiture électrique.
Enfin, mentionnons les différents types de piles à combustibles qui utilisent la combinaison d'un combustible comme l'hydrogène avec de l'oxygène et permettent de fournir des puissances supérieures à 100 kW.
PROBLÈMES
Niveau pratique
11-1 Quelle est la différence entre une pile primaire et une pile secondaire?
11-2 Nommez deux types de pile primaire et deux types de pile secondaire.
11-3 Pourquoi ne doit-on jamais fumer dans une salle de batteries?
11-4 On se propose d'utiliser une batterie de piles au carbone-zinc pour faire démarrer un moteur diésel de 10 kW.
Est-ce un choix judicieux?
Quel genre de batterie serait plus approprié?
11-5 Quel est l'avantage des piles scellées?
Pourquoi faut-il éviter de sceller les piles complètement?
11-6 Une batterie d'autobus a une capacité de 300 A.h et sa tension nominale est de 12V. Quel est le débit normal en ampères pendant 8h?
Pendant combien de temps peut-on en tirer un courant de 10A?
Si la batterie est déchargée, quel doit être le courant maximal pendant la période de charge?
11-7 Une batterie au nickel-cadmium de 12V aune capacité de 100 A.h basée sur une période de décharge de 5 heures.
Calculez la tension aux bornes lorsque le courant est de 50A sachant que la tension à circuit ouvert est de 13V et que sa résistance interne est de 2,4 mΩ.
11-8 On veut construire une batterie de 120V utilisant soit des piles au plomb, soit des piles au nickel-cadmium.
Combien de piles seraient requises dans chaque cas?
11-9 Un pèse-acide de batterie d'automobile indique une densité d'électrolyte de 1,1.
Doit-on recharger la batterie?
Quelle est la densité indiquée lorsque la batterie est chargée complètement?
Niveau intermédiaire
11-10 La force électromotrice d'une pile sèche est de 1,5V à circuit ouvert. La tension aux bornes est de 1,2V quand une résistance de 6Ω est connectée entre ses bornes.
Quelle est la résistance interne de la pile?
11-11 On veut alimenter une bobine avec un courant de 300 mA pendant une période d'environ 100 heures.
Si la résistance de la bobine est de 20Ω, combien de piles de 1,5 V sont nécessaires et comment doit-on les connecter? Chaque pile a une capacité de 30 A.h.
11-12 Dans le problème 11-11, s'il fallait alimenter la bobine pendant 250 heures, combien de piles seraient nécessaires et comment faudrait-il les connecter?
11-13 Une salle d'accumulateurs contient 500 piles secondaires donnant une tension de 120V.
Si l'on surcharge les batteries pendant 4 heures, quelle quantité d'hydrogène sera libérée, le courant de charge étant de 10A?
11-14 Une batterie au carbone-zinc de 6V ales dimensions suivantes: 135 mm x 70 mm x 100 mm.
D'après le tableau 11-1, calculer:
a) l'énergie disponible en joules
b) la capacité approximative en ampères-heures de la batterie
c) le nombre d'heures pendant lesquelles on peut alimenter une lampe de 6 W branchée sur la batterie
11-15 Une pile au mercure pour montre a un diamètre de 11,5 mm, une épaisseur de 5,3 mm et pèse 2,55 g.
Sa capacité étant de 220 mA.h, déterminez le nombre d'heures de fonctionnement de la montre si celle-ci tire un courant constant de 15 µA.
11-16 Dans le problème 11-15, calculez l'énergie massique et volumique de la pile et comparez vos résultats avec les données du tableau 11-1.
11-17 Décrivez le principe de fonctionnement d'une pile à combustible.
Niveau avancé
11-18 Un cheval pesant 750 kg peut débiter une puissance de 1 hp pendant 8 heures.
a) Calculer la masse d'une batterie au nickel-cadmium pouvant débiter la même quantité d'énergie avant qu'il faille la recharger.
b) Répéter les calculs pour une batterie au plomb.
11-19 Une pile au nickel-cadmium peut débiter un courant de 19,5A pendant 8 heures avant que sa tension baisse à 1V.
La même pile peut débiter un courant de 940A pendant 5 secondes avant que sa tension baisse à 1V.
a) Calculer la capacité en A.h dans ces deux cas.
b) Quelle est la résistance interne de la pile à la fin de la période de 5 secondes?
11-20 Une batterie de 120V servant à propulser une voiture de mine doit fournir une puissance moyenne de 21kW pendant 6 heures.
Si l'on utilise des piles au plomb, calculez la masse approximative de la batterie et le nombre de piles requises.
Quel est le courant moyen débité? (Dans le tableau 11-1, prendre 80 kJ/kg.)
11-21 On doit prévoir une source d'énergie d'urgence pouvant donner une puissance de 500 kW, à 240V pendant 6 heures.
Si l'on utilise des piles au plomb dont la durée de vie est de 15 ans et plus, calculer :
a) le volume des piles
b) le groupement des piles si chacune a une capacité de 150 A-h
11-22
a) Calculer le rendement de la pile à combustible illustrée à la Fig. 11-23.
b) Quelles sont la tension et le courant approximatifs de cette pile?
Réponses
6) 37,5A; 30h; 300A; 7) 12,88V;
8) plomb: 70; NiCd: 120;
9) oui; 1,28; 10) 1,5Ω; 11) 4 piles en série;
12) 12 piles (3 groupes de 4 en série);
13) 1200 L; 14a) 510 kJ; 14b) 23,6
A.h; 14c) 23,6 h; 15) 1,67 an;
16) 420 kJ/kg; 1940 kJ/dm3; 18) de
180 kg à 310 kg ;
19a) 156 A.h; 1,3 A.h; 19b) 0,32Ω; 20) 5670 kg; 70
piles; 175A;
21a) 72 m3; 21b) 83 groupements en parallèle de 141
piles en série;
22a) 36%; -320V; -700A
