Métallurgie
Le Soudage
oxyacétylénique
Le travail du soudeur consiste à unir des pièces métalliques
grâce à plus ou moins de chaleur. Comme la chaleur engendre dans la structure du
métal des réactions et des transformations notables, il importe au soudeur de
les prévoir en possédant des notions précises sur la structure du fer et de ses
alliages.
Soudabilité
Qu'est-ce que la soudabilité? C'est l'ensemble des propriétés
qui rendent un alliage plus ou moins facilement soudable. En règle générale, la
soudabilité est l'inverse de la dureté; ainsi, plus un acier contient de
carbone, plus il peut acquérir de dureté par la trempe, mais par contre plus il
s'avère difficile à souder.
Un alliage est soudable quand on peut, par un procédé
quelconque, le souder sans provoquer de fissures, de porosités, tout en
conservant ses propriétés physiques et mécaniques originelles.
La soudabilité repose sur le procédé de soudage, la forme et les
dimensions des pièces et la faculté d'appliquer certaines techniques. Les
principaux facteurs qui déterminent la soudabilité sont:
1 — la conductibilité thermique du métal;
2 — son coefficient de dilatation;
3 — sa fragilité à chaud;
4 — son degré d'oxydation;
5 — la possibilité d'évaporation d'ingrédients;6 — son changement métallurgique
lors du chauffage;
7 — sa capacité d'absorption de gaz dans le bain de fusion.
On peut dire que tous les aciers sont soudables, mais à des
degrés différents et suivant certaines précautions.
Métaux ferreux
La métallurgie range les métaux en deux catégories: 1) les
métaux ferreux où le principal ingrédient est le fer, par exemple, le fer, la
fonte, les aciers; 2) les métaux non ferreux, tels le chrome, le nickel,
l'aluminium, le cuivre, l'étain ou les alliages de ces éléments. L'élément fer,
à l'état pur, est comparativement mou, ductile et d'une charge de rupture peu
élevée, mais son point de fusion (2800° F.) est supérieur à celui de la plupart
des alliages contenant du fer.
On l'extrait à l'état d'oxydes de fer (hématites, oligistes,
etc.) ou de carbonates. Le minerai est ensuite réduit dans les hauts-fourneaux,
puis affiné dans des fours qui produisent le fer pur ou les aciers.
Contrairement au cuivre, à l'aluminium, etc., le fer pur n'a pratiquement pas
d'applications commerciales. Pour améliorer les propriétés du fer, on lui ajoute
certains éléments, dont le carbone, le silicium, le manganèse, le soufre, le
phosphore, le nickel, le chrome, le molybdène, etc.
Un alliage est un mélange de deux ou plusieurs métaux, parfois
de métaux et de métalloïdes. Fait à retenir, le point de fusion d'un alliage est
toujours moins élevé que celui du métal pur auquel on a ajouté des éléments.
Le soudeur est intéressé à connaître ce qui se passe au moment de la chauffe et
du refroidissement de l'alliage.
Soit un alliage de fer contenant 0.83% de carbone que l'on
chauffe et ramène ensuite à la température de l'atelier. La figure 100 montre
trois agrandissements d'une parcelle 1000 fois, 2500 fois et 35 millions de fois
plus grosse que vue à l'oeil nu. Actuellement, on ne peut voir à la lumière
ordinaire du microscope que les deux premiers agrandissements.

Fig. 100 —
(A) surface polie, grandeur naturelle,
(B) premier agrandissement, 1000 fois la grandeur naturelle,
(C) deuxième agrandissement, 2500 fois la grandeur naturelle,
(D) troisième agrandissement, 35 millions de fois la grandeur naturelle (Linde
Air Products Ltd.)
Une méthode spéciale aux rayons X permet seule de déterminer
l'arrangement atomique de la troisième vue: un cube avec un atome de fer sur
chaque arête et un atome au centre du cube. C'est ce qu'on appelle le fer alpha
(alpha iron). Cet arrangement atomique se retrouve sur tous les atomes de fer, à
la température ordinaire, sauf sur certaines catégories d'acier. L'étude de
l'action de la chaleur sur le grain du fer fera comprendre un phénomène
important en soudage.
Si l'on pouvait sectionner un cristal d'acier, à 0.83% de
carbone, on constaterait qu'il est formé d'une série de lamelles (fig. 101)

Fig. 101 Structure perlitique
Une lamelle de fer presque pur alternant avec une lamelle
composée de fer et de carbone combinés que l'on nomme cémentite ou carbure de
fer (cémentite or iron carbide). Ce carbure de fer contient trois particules de
fer pour une de carbone (Fe3C).
Tout le carbone de l'acier apparaît sous forme de carbure de fer
ou cémentite, ou encore de carbures d'autres éléments contenus dans le métal. Ce
carbure, très dur et fort, n'est pratiquement pas ductile. L'ensemble de ces
lamelles se nomme perlite (pearlite). La perlite est un ensemble de lamelles de
ferrite gris pâle et de cémentite d'un gris plus foncé qui alternent
régulièrement.
Un alliage de fer avec 0.83% de carbone ne contient que de la
perlite. Si la teneur en carbone est moindre, il apparaît alors des grains de
ferrite au milieu de grains de perlite (fig. 102); mais si l'alliage contient
beaucoup plus de carbone, il apparaît alors des grains de cémentite au milieu de
grains de perlite.
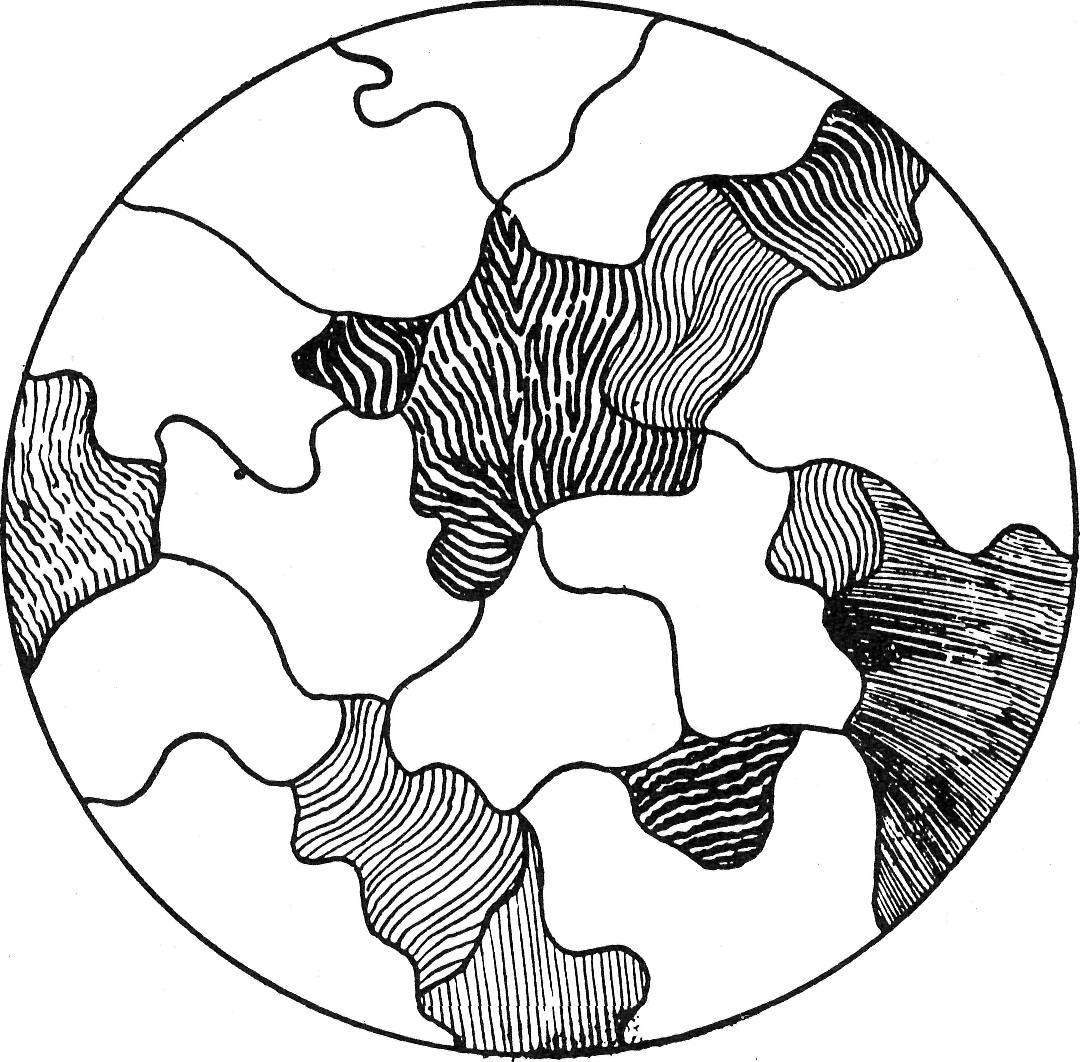
Fig. 102 — Photomicrographie d'acier contenant moins de 0.83% de carbone
(Linde Air Products Ltd.)
Chauffons maintenant une pièce de fer à 0.83% de carbone. Nous
verrons dans les pages suivantes les effets de la chaleur sur le métal. Si la
surface est polie, on observe que l'acier change de couleur; elle passe du gris
au jaune, puis au mauve, ensuite au bleu, puis elle redevient gris mat avant de
devenir rouge.
À mesure que l'on chauffe, le métal se dilate; à un moment
donné, le fer devient rouge brillant, la dilatation s'arrête et il y a même un
certain retrait dans la pièce. La température cesse momentanément de monter,
même si on continue de chauffer. Il se produit une transformation importante
dans la structure même du métal. Ce moment d'arrêt et de changement se produit
entre 1300° et 1400° F. C'est le point de recalescence ou température critique.
Cet instant passé, la température recommence à augmenter et la dilatation se
poursuit.
Revenons au point de recalescence pour examiner ce curieux
phénomène. S'il était possible de grossir un cristal du métal 35,000,-000 de
fois, on observerait qu'au moment de recalescence les atomes se déplacent; plus
d'atome au centre du cube, mais un à chaque coin et un à chaque face du cube
(fig. 103).
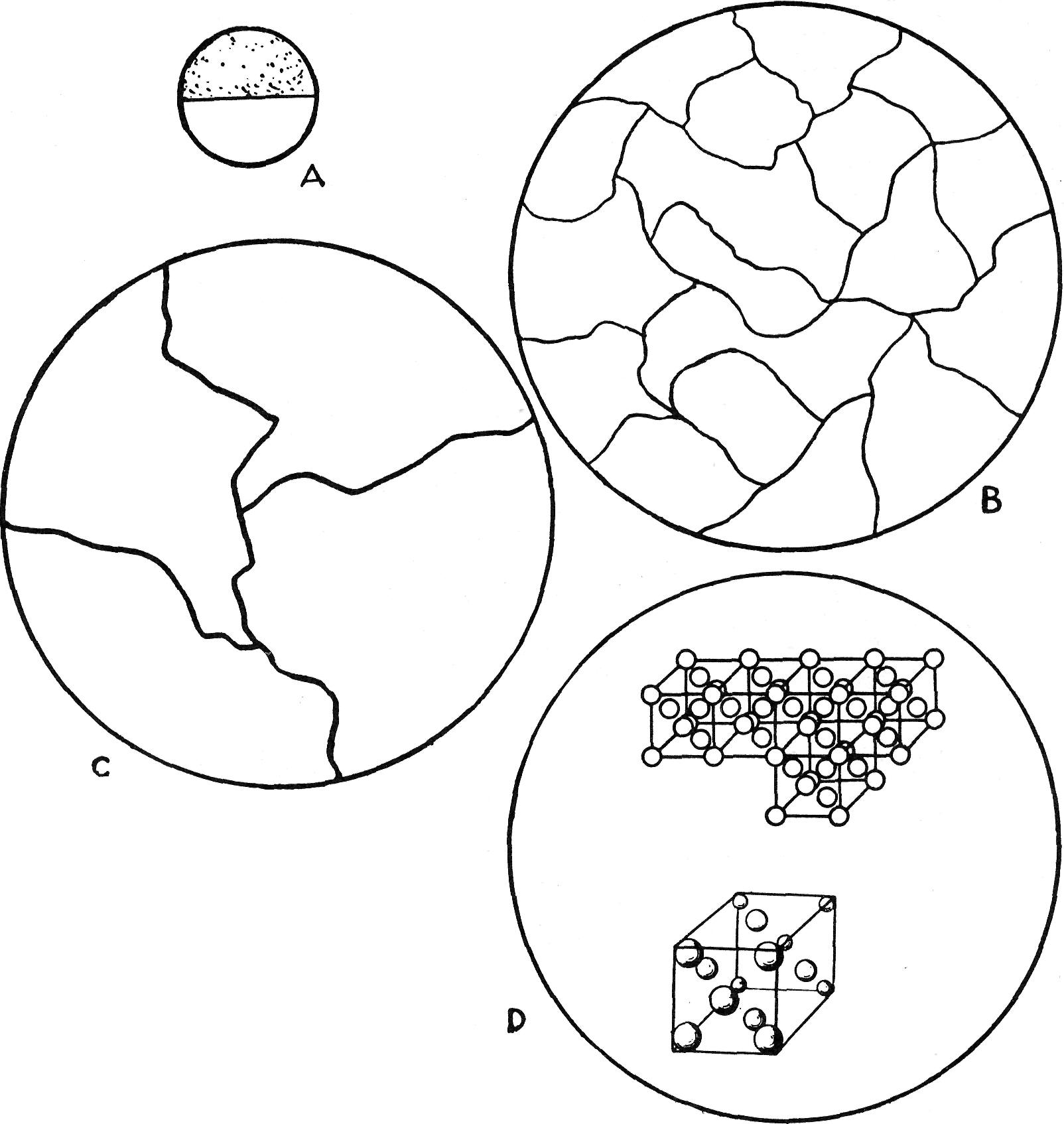
Fig. 103 — Structure austénitique
A) surface polie, grandeur naturelle
B) premier agrandissement, 1000 fois la grandeur naturelle
C) deuxième agrandissement, 2500 fois la grandeur naturelle
D) troisième agrandissement, 35 millions de fois la grandeur naturelle
(Linde Air Products Ltd.)
La molécule de fer est donc devenue plus dense, ce qui explique
le retrait subit du métal au point de recalescence. Cet arrangement atomique du
fer gamma (gamma iron) se maintient tant que le métal ne descend pas à une
température inférieure au point de recalescence; le métal conserve même cet
arrangement à toutes températures dans certains alliages.
La structure perlitique du métal disparaît à cette température,
la cémentite se dissocie en fer pur et en carbone pur lequel se dissout
uniformément dans le fer. A ce stage, le métal encore solide, d'où le nom de
solution solide, existe sous une forme austénitique; il est non magnétique et
dissout le carbone et les autres éléments de l'alliage. À mesure que la
température s'élève, le grain du métal grossit jusqu'à ce que le métal devienne
en fusion, alors que toute la structure des cristaux se brise; il n'y a plus
aucun lien atomique.
Pendant le refroidissement, il se forme des cristaux
austénitiques qui grossissent jusqu'à ce que toute la masse devienne solide; le
métal se refroidit graduellement jusqu'à la température critique, entre 1300° à
1400° F. alors que la chute de température s'arrête. À ce moment, le métal se
dilate par suite d'un arrangement atomique moins dense et passe de l'état gamma
à l'état alpha. Le métal reprend sa forme perlitique si aucun changement brusque
de température ne vient déranger la marche normale du refroidissement.
Que la masse soit chauffée lentement ou rapidement, les effets
sont les mêmes, sauf que le rythme des transformations s'accélère. Cependant, si
le refroidissement est rapide, les résultats se révèlent différents. La masse en
fusion refroidit et passe à l'état solide et austénitique, c'est-à-dire que le
carbone se trouve à l'état dissous dans le métal. Si à ce moment (entre 1450° F.
et 1600° F.), on refroidit l'acier rapidement en le plongeant dans l'eau froide,
le métal franchit trop rapidement la température critique et la masse
transformée ne peut reprendre sa forme perlitique; elle devient alors
martensitique. C'est la plus dure, la plus forte et la plus fragile des
structures de l'acier. Les cristaux prennent alors la forme de fines aiguilles
très dures et entrelacées.

Fig. 104 — Structure martensitique — (Linde Air Products Ltd.)
Toute la discussion qui précède réfère à un acier contenant
0.83% de carbone. Sur les aciers à plus basse teneur de carbone (jusqu'à environ
0.40%) le même phénomène se produit mais les cristaux martensitiques sont plus
espacés et la dureté du métal est moindre. À moins de 0.35% de carbone, le
durcissement dû au trempage n'est plus appréciable. Plus le carbone augmente
au-dessus de 0.83% de carbone, plus le durcissement dû au trempage est intense.
Le maximum, en pratique, est environ 1.2% de carbone.
Si l'alliage contient plus de 1.7% de carbone, celui-ci ne
pourra se dissoudre complètement en carbures de fer, et nous aurons alors des
flocons de graphite pur mélangés à la ferrite ou à la perlite pour former de la
fonte.
Jusqu'ici, nous n'avons parlé que du fer et du carbone. L'acier
contient cependant quelques autres éléments: manganèse, phosphore, silicium,
soufre, oxygène, etc. et certaines impuretés plus ou moins nuisibles. Dans un
alliage de bonne qualité, le pourcentage de ces impuretés doit être tel qu'il
n'affecte pas les propriétés du métal. Ces corps étrangers se combinent
chimiquement ou demeurent en solution avec le matériel.
Examinons brièvement les effets de ces éléments sur l'alliage.
Phosphore
Les aciers usuels contiennent rarement plus de 0.1% de cet
élément indésirable; une plus grande quantité rend le métal fragile. Au-dessous
de 0.1%, il tend à éliminer les porosités (blow-holes) et amoindrit le retrait.
Dans la fonte, il augmente la fluidité du métal et sa présence n'accroît pas la
fragilité par le fait qu'il n'entre pas en solution avec le métal à cause du
carbone.
Silicium
Dans les aciers ordinaires, le pourcentage de silicium est de
0.05% à 0.3%. Il a l'avantage de se combiner à l'oxvgène pour former du bioxyde
de silicium qui flotte à la surface du métal en fusion, nettoyant celui-ci de
son oxygène.
Soufre
Les métallurgistes tentent de réduire au minimum la teneur du
soufre, autre ingrédient indésirable. Il se comb'ne au fer pour former des
sulfures qui enveloppent les cristaux de fer d'une membrane affaiblissant le
métal lorsqu'il est chaud. Il existe cependant une catégorie d'acier connue sous
le nom de High-Sulphur Free-Machining Steel qui renferme jusqu'à 0.23% de
soufre, ce qui le rend très facilement usinable. Le soudeur doit se montrer très
prudent en soudant les aciers qui contiennent plus de 0.05% de soufre, car ils
produisent des soudures poreuses et fragiles.
Manganèse
Un léger pourcentage de manganèse dans l'acier est
recommandable. L'acier doux en contient environ 0.4%. Le manganèse a la
propriété de se combiner au soufre pour produire du sulfure de manganèse,
composé qui se sépare en petits globules sans effet sur les propriétés de
l'acier. Le manganèse désoxyde aussi le métal; lorsque l'alliage contient
environ 1% de manganèse, l'acier devient alors dur et résistant à l'usure. Quand
l'acier en contient de 1% à 7%, on ne connaît aucun procédé efficace pour
éliminer sa dureté.
Si l'acier contient de 12 à 14% de manganèse, il possède alors
des caractéristiques tout à fait spéciales; on le nomme acier au manganèse
austénitique. C'est un alliage très dur, résistant à l'impact et à l'abrasion;
on s'en sert pour les concasseurs, les dents de pelles mécaniques, dans les
carrières et les mines, pour les aiguillages de rails de chemins de fer, etc.
Cependant, les aciers au manganèse doivent être traités avec
précaution par le soudeur, car ils subissent des réactions spéciales sous
l'effet de la chaleur.
1 — Tel que coulé, cet alliage est faible et fragile;
2 — On améliore ses propriétés par un saisissement dans l'eau froide, après
l'avoir porté à la température de 1900° F.
3 — Après avoir subi ce traitement thermique, l'alliage redevient faible et
fragile, si sa température est élevée entre 800° et 900° F.; même un
saisissement à froid n'améliorera pas ses caractéristiques. Dans ce cas, on doit
recommencer le traitement à 1900° F. et aussi le saisissement. Un
refroidissement lent après une chauffe à 1900° F. rend l'acier fragile.
4 — Si l'acier au manganèse austénitique est chauffé à plus de 2190° F., il
devient fragile en permanence.
Le soudage oxyacétylénique de cette catégorie d'acier n'est pas
recommandé à cause du trop grand apport de chaleur. On utilise plutôt l'arc
électrique en employant une technique spéciale.
Chrome
Le chrome sert ordinairement à la fabrication d'alliages avec
l'acier. Avec l'addition d'un autre élément (carbone, vanadium, tungstène,
molybdène), une légère quantité de chrome produit un excellent acier. Un
pourcentage assez élevé de chrome (7% à 30%) produit des aciers inoxydables,
objet d'un chapitre subséquent.
Nickel
Le nickel est un autre élément qui procure à l'acier des
propriétés excellentes. L'alliage peut contenir de 1% à 46% de nickel, suivant
que l'on désire obtenir un acier rigide pour structures ou un alliage très dur
et très résistant à la corrosion dans le cas des aciers inoxydables.
Oxygène
L'oxygène crée beaucoup d'ennuis aux métallurgistes et aux
soudeurs. À froid, il s'attaque aux métaux, et particulièrement au fer et aux
aciers, pour former cet oxyde de fer connu sous le nom de rouille. Tous les
métaux ont une très grande affinité pour l'oxygène à chaud; tous les procédés de
soudage visent à prévenir cette oxydation qui affaiblit la soudure ou le métal
adjacent.
Citons quelques précautions contre l'oxydation du métal: en
soudage oxyacétylénique, le panache de la flamme forme autour du bain de fusion
une enveloppe protectrice contre l'oxydation par l'oxygène de l'air. Dans le
soudage avec gaz inerte (heliarc ou argon arc), le seul but de l'hélium ou de
l'argon est de former une atmosphère inerte et imperméable à l'oxygène de
l'atmosphère.
L'enrobage des électrodes à arc isolé (shielded arc) a pour but
de prévenir l'oxydation du métal au cours de la fusion et du refroidissement.
Les moyens développés pour réduire l'infiltration d'oxygène démontrent
l'influence néfaste de l'oxygène sur les métaux.
;
Ces quelques notions de métallurgie ne visent qu'à expliquer les
changements que subit la structure du métal pendant le soudage des aciers. Cette
opération, en effet, nécessite un apport considérable de chaleur pour élever une
pièce de la température atmosphérique à son point de fusion. Cette élévation de
température entraîne un changement dans la structure du métal et spécialement
dans la zone immédiatement affectée par la chaleur:
1 — dans le métal fusionné;
2 — dans le métal déposé;
3 — dans la zone adjacente à la soudure.
Au-dessus du point de recalescence ou température critique (env.
1400° F.) le grain de l'acier grossit dans toute la région atteinte par cette
température. Le joint de soudure des aciers à basse teneur de carbone que
n'affecte pas un tel changement possède des propriétés physiques équivalentes et
quelquefois supérieures à celles du métal de base lui-même.
Si le métal refroidit lentement, sans subir aucun travail à
chaud, le grain dans la zone affectée par la soudure garde à peu près les mêmes
dimensions que celles qui sont atteintes après la température critique. Après la
fusion, la solidification commence à plusieurs endroits, alors que les molécules
du métal se placent pour former des cristaux de forme régulière; ces cristaux
grossissent jusqu'à ce qu'ils touchent d'autres cristaux qui grossissent eux
aussi. Le métal solidifié est ainsi composé de grains de formes irrégulières.
Quand la structure métallique se brise, la fracture dans chaque grain apparaît
sur le plan de clivage (cleavage plane); ce sont, par exemple, les lamelles de
perlite qui se séparent et non les grains du métal qui se brisent.
Par conséquent, plus le grain du métal est fin, plus le métal
est fort, car la fracture doit changer de direction plus souvent. Il existe deux
moyens d'obtenir un grain fin sur l'acier doux chauffé. Le premier consiste à
travailler le métal à chaud, c'est-à-dire à le forger, à le laminer ou à le
marteler alors qu'il est dans la limite austénitique; le grain n'a pas alors la
possibilité de grossir. Par conséquent, le métal conserve une structure fine si
on le travaille jusqu'à ce que la température soit inférieure au point de
recales-cence. On obtient ainsi un métal travaillé ou fini à chaud (hot worked
or hot rolled). Si, an contraire, le métal est travaillé à une température
inférieure au point de recalescence, nous obtenons alors un métal travaillé à
froid (cold worked ou cold rolled).
Le second moyen d'affiner le grain de l'acier doux consiste à le
normaliser, c'est-à-dire à le chauffer de nouveau juste au-dessus de sa
température critique; en refroidissant, le métal prend une structure fine. Ce
résultat peut s'obtenir en soudage soit en chauffant la pièce, soit en exécutant
le soudage en plusieurs passes; dans ce dernier cas, le deuxième cordon de
soudure affine le grain du premier, et ainsi de suite.
Encore une fois, le soudage d'acier à basse teneur de carbone
n'occasionne, en général, pas de troubles au point de vue métallurgique, mais il
en va bien autrement pour les aciers à haute teneur de carbone.
Ici, plusieurs facteurs peuvent changer les résultats, entre
autres la sorte d'alliage, les dimensions de la pièce, le degré de température
et la vitesse de refroidissement de la pièce. Si l'on refroidit la pièce très
rapidement, le grain est fin et la structure martensitique; la pièce est
trempée, sa dureté et sa fragilité seront directement proportionnelles à la
rapidité du refroidissement.
Aussi le soudeur doit-il prévoir tous ces phénomènes et, au
besoin, préchauffer et post-chauffer les pièces, afin d'éviter cette fragilité
qui provoque souvent des fissures du métal. L'effet contraire peut évidemment se
produire; si l'on chauffe une pièce déjà trempée, celle-ci perdra ses qualités
qu'il faudra lui redonner par un traitement thermique convenable.
Recherche personnalisée






